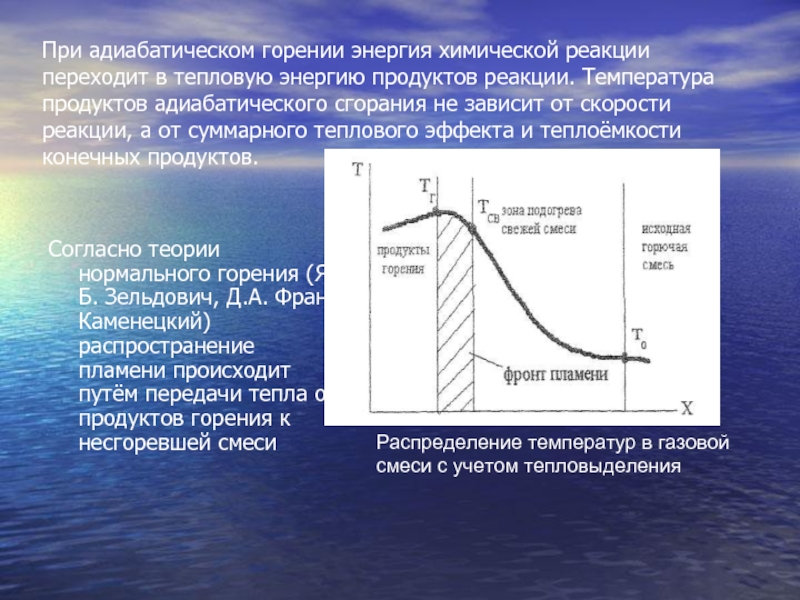
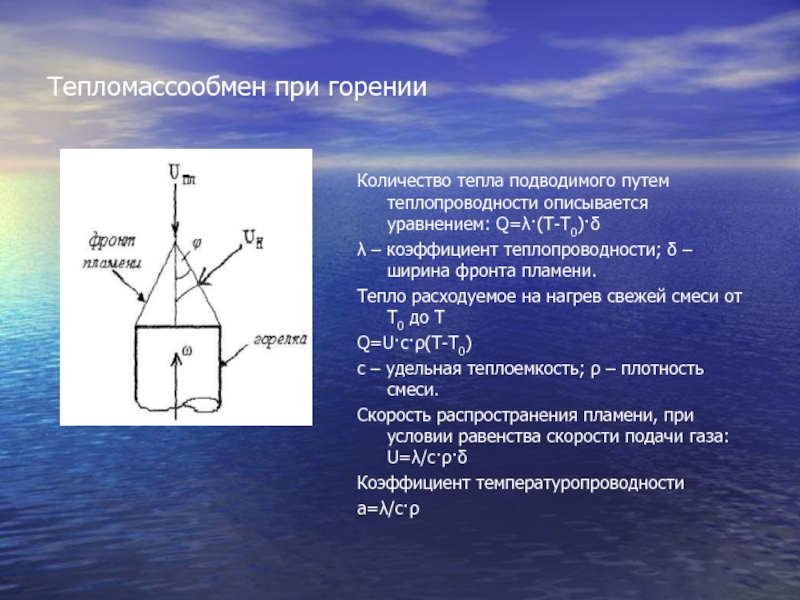
продуктов реакции. Температура продуктов адиабатического сгорания не зависит от скорости
реакции, а от суммарного теплового эффекта и теплоёмкости конечных продуктов.Согласно теории нормального горения (Я.Б. Зельдович, Д.А. Франк-Каменецкий) распространение пламени происходит путём передачи тепла от продуктов горения к несгоревшей смеси
Распределение температур в газовой смеси с учетом тепловыделения