Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алюминий 9 класс
Содержание
- 1. Алюминий 9 класс
- 2. АЛЮМИНИЙ Его физические и химические свойства
- 3. I. Характеристика химического элемента: Порядковый номерОтносительная
- 4. Al27+130283Электронная формулаСтроение электронной оболочки:Степень окисления алюминия в соединениях = + 3.
- 5. II. Физические свойства алюминия:
- 6. III. Химические свойства алюминия: Алюминий – активный металл?Al - 3ē Alвосстановитель+30
- 7. 1. Взаимодействие алюминия с простыми веществами:
- 8. 2. Взаимодействие алюминия со сложными веществами: с кислотами со щелочами с солями с оксидамиИнструкционная карта
- 9. Слайд 9
- 10. Проверим свои знания !1 В2
- 11. Подведение итогов урока РефлексияНад какой темой мы
- 12. Домашнее задание: § 16,
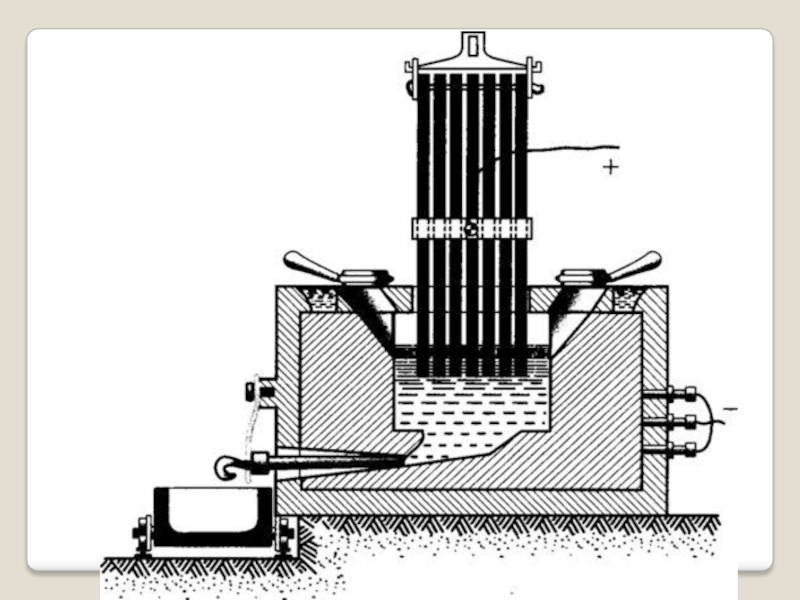
- 13. Алюминий ПолучениеглавнаяДалее
- 14. Слайд 14
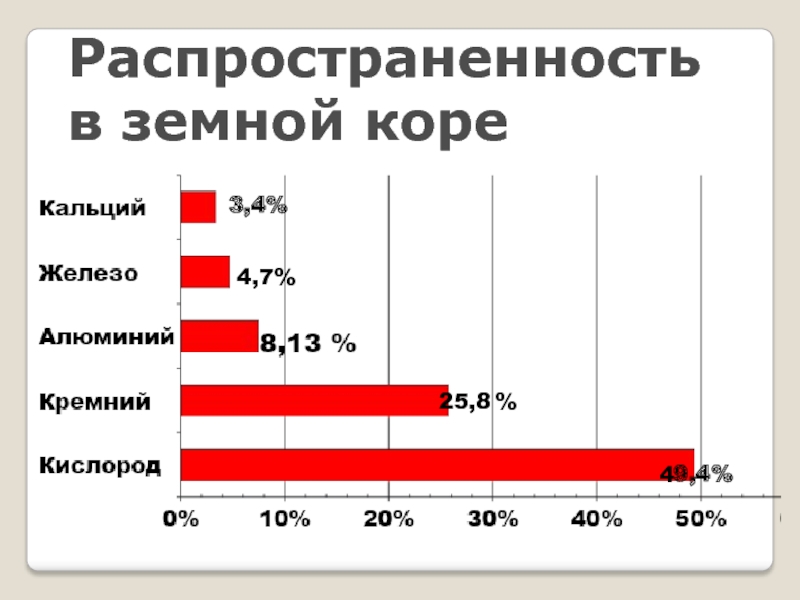
- 15. Распространенность в земной коре25,8 %49,4%4,7%3,4%
- 16. Слайд 16
- 17. Корунд - наиболее устойчивая модификация оксида алюминия
- 18. Al2O3 + 6HCl = 2AlCl3 + 3H2OсплавлениеAl2O3
- 19. Гидроксид адюминия (гидраргиллит)Свежеосаждённый гидроксид алюминия может взаимодействовать
- 20. Соли алюминия Безводный хлорид алюминия АlСl3 используется
- 21. Домашнее задание: § 16,
- 22. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3I. Характеристика химического элемента:
Порядковый номер
Относительная атомная масса
Заряд ядра
атома
Число протонов
Число электронов
Число нейтронов
Al
27
+13
0
№ = 13
Ar (Al) =
27Z = +13
p+ = 13
ē = 13
n =27-13=14
0
Слайд 4Al
27
+13
0
2
8
3
Электронная формула
Строение электронной оболочки:
Степень окисления алюминия в соединениях = +
3.
Слайд 5II. Физические свойства алюминия:
Алюминий – металл
серебристо- белого цвета, лёгкий
t пл.=6600С, ковок, пластичен, электро- и
теплопроводен, легко поддаётся обработке, образует лёгкие и прочные сплавыСлайд 82. Взаимодействие алюминия со сложными веществами:
с кислотами
со щелочами
с солями
с оксидами
Инструкционная карта
Слайд 10Проверим свои знания !
1 В
2 Б,
В,Г,
3 А, В
4 В
5
В“5” – нет ошибок
“4” – 1 ошибка
“3” – 2 ошибки
“2” – 3 ошибки
Слайд 11Подведение итогов урока Рефлексия
Над какой темой мы сегодня работали?
Что нового
вы узнали об алюминии?
Решили ли мы проблему об активности алюминия?
Какими путями решали эту проблему?
К каким выводам пришли?
Оцените свою работу на уроке:
материал усвоен
(на всех этапах урока "4", "5")
материал усвоен недостаточно
(оценки "3", "4")
Слайд 12 Домашнее задание: § 16, стр 107-111 вопросы 4– обязательная часть Индивидуальная часть: 1.Составьте
текст рекламы алюминия или изделий из него.
2.Составьте кроссворд по теме
Спасибо за урок!
Слайд 18
Al2O3 + 6HCl = 2AlCl3 + 3H2O
сплавление
Al2O3 + 2NaOH =
2NaAlO2 + H2O
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Химические свойства оксида алюминия:
нерастворим в воде, амфотерен,
взаимодействует с кислотами и щелочами.
Слайд 19Гидроксид адюминия (гидраргиллит)
Свежеосаждённый гидроксид алюминия может взаимодействовать с:
кислотами
щелочами
В растворах:
При сплавлении:
При нагревании разлагается:
Слайд 20Соли алюминия
Безводный хлорид алюминия АlСl3 используется в химической практике в
качестве катализатора при переработке нефти
Сульфат алюминия Al2(SO4)3•18Н2O применяется как коагулянт
при очистке водопроводной воды, а также в производстве бумаги.
Широко используются двойные соли алюминия — квасцы KAl(SO4)2•12H2O, NaAl(SO4)2•12H2O, NH4Al(SO4)2•12H2O и др. — обладают сильными вяжущими свойствами и применяются при дублении кожи, а также в медицинской практике как кровоостанавливающее средство.
Полевые шпаты — наиболее распространенные алюмосиликаты.
На их долю приходится более 1/2 массы земной коры. Это минералы
ортоклаз K[AlSi3O8], альбит Na[AlSi3O8],
анортит Ca[Al2Si2O8],
нефелин Na2K2[Al2Si2O8].
Слайд 21 Домашнее задание: § 16, до конца вопросы: упр.6– обязательная часть Индивидуальная часть: 1. Биологическая
роль алюминия 2. Подготовить небольшие доклады, презентации о применении алюминия.
(Алюминий – тара и упаковка, алюминий в фармацевтике, транспорте, электрике и машиностроении, строительстве)
Спасибо за урок!