Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Изотопы
Содержание
- 1. Изотопы
- 2. ИЗОТОПЫ – разновидности одного и того же
- 3. Атом любого химического элемента состоит из положительно
- 4. В 1932 был открыт нейтрон – частица,
- 5. В природе встречаются как стабильные изотопы, так
- 6. Открытие изотоповВ 1808 английский ученый натуралист Джон
- 7. Важным шагом на пути к открытию изотопов
- 8. Независимое подтверждение существования стабильных изотопов было затем
- 9. Применение изотоповРазнообразные изотопы химических элементов находят широкое
- 10. Изотопные технологии находят широкое применение в медицине.
- 11. Спасибо за внимание!
- 12. Скачать презентанцию
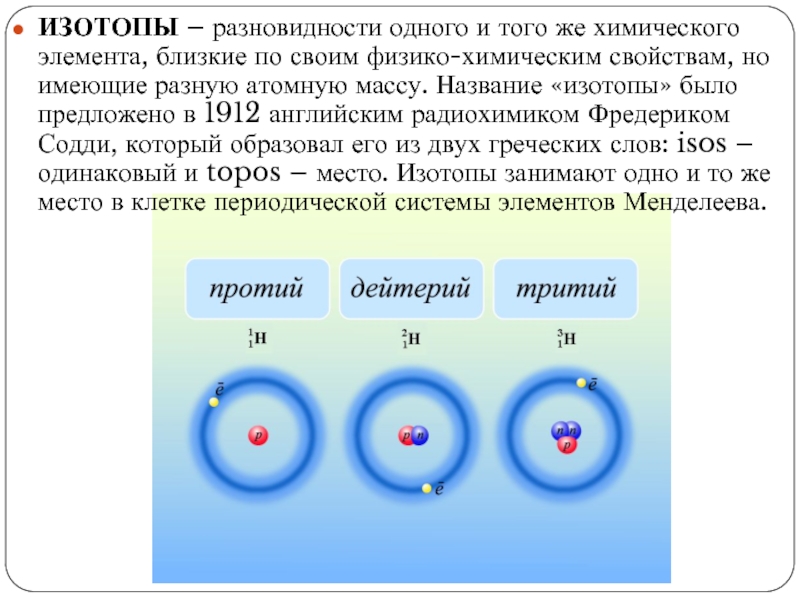
ИЗОТОПЫ – разновидности одного и того же химического элемента, близкие по своим физико-химическим свойствам, но имеющие разную атомную массу. Название «изотопы» было предложено в 1912 английским радиохимиком Фредериком Содди, который образовал
Слайды и текст этой презентации
Слайд 3Атом любого химического элемента состоит из положительно заряженного ядра и
окружающего его облака отрицательно заряженных электронов. Положение химического элемента в
периодической системе Менделеева (его порядковый номер) определяется зарядом ядра его атомов. По образному выражению Ф. Содди, атомы изотопов одинаковы «снаружи», но различны «внутри».Слайд 4В 1932 был открыт нейтрон – частица, не имеющая заряда,
с массой, близкой к массе ядра атома водорода – протона,
и создана протонно-нейтронная модель ядра. В результате в науке установилось окончательное современное определение понятия изотопов: изотопы – это вещества, ядра атомов которых состоят из одинакового числа протонов и отличаются лишь числом нейтронов в ядре. Каждый изотоп принято обозначать набором символов , где X – символ химического элемента, Z – заряд ядра атома (число протонов), А – массовое число изотопа (общее число протонов и нейтронов в ядре, A = Z + N). Поскольку заряд ядра оказывается однозначно связанным с символом химического элемента, часто для сокращения используется просто обозначение AX.Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2H и 3H носят названия дейтерия и трития.
Слайд 5В природе встречаются как стабильные изотопы, так и нестабильные –
радиоактивные, ядра атомов которых подвержены самопроизвольному превращению в другие ядра
с испусканием различных частиц. Сейчас известно около 270 стабильных изотопов. Число нестабильных изотопов превышает 2000, подавляющее большинство их получено искусственным путем в результате осуществления различных ядерных реакций. Число радиоактивных изотопов у многих элементов очень велико и может превышать два десятка. Число стабильных изотопов существенно меньше, некоторые химические элементы состоят лишь из одного стабильного изотопа (бериллий, фтор, натрий, алюминий, фосфор, марганец, золото и др.). Наибольшее число стабильных изотопов – 10 обнаружено у олова, у железа, например, их – 4, у ртути – 7.Слайд 6Открытие изотопов
В 1808 английский ученый натуралист Джон Дальтон впервые ввел
определение химического элемента как вещества, состоящего из атомов одного вида.
В 1869 химиком Д. И. Менделеевым была открыт периодический закон химических элементов. Одна из трудностей в обосновании понятия элемента как вещества, занимающего определенное место в клетке периодической системы, заключалась в наблюдаемой на опыте нецелочисленности атомных весов элементов. В 1866 английский физик и химик – сэр Вильям Крукс выдвинул гипотезу, что каждый природный химический элемент представляет собой некоторую смесь веществ, одинаковых по своим свойствам, но имеющих разные атомные массы, однако в то время такое предположение не имело еще экспериментального подтверждения.Слайд 7Важным шагом на пути к открытию изотопов стало обнаружение явления
радиоактивности и сформулированная Эрнстом Резерфордом и Фредериком Содди гипотеза радиоактивного
распада: радиоактивность есть не что иное, как распад атома на заряженную частицу и атом другого элемента, по своим химическим свойствам отличающийся от исходного. В результате возникло представление о радиоактивных рядах или радиоактивных семействах, в начале которых есть первый материнский элемент, являющийся радиоактивным, и в конце – последний стабильный элемент. Анализ цепочек превращений показал, что в их ходе в одной клеточке периодической системы могут оказываться одни и те же радиоактивные элементы, отличающиеся лишь атомными массами. Фактически это и означало введение понятия изотопов.Слайд 8Независимое подтверждение существования стабильных изотопов было затем получено в экспериментах
Томсона и Астона в 1912–1920 с пучками положительно заряженных частиц,
выходящих из разрядной трубки.В 1919 Астон сконструировал прибор, названный масс-спектрографом. В качестве источника ионов по-прежнему использовалась разрядная трубка, однако Астон нашел способ, при котором последовательное отклонение пучка частиц в электрическом и магнитном полях приводило к фокусировке частиц с одинаковым значением отношения заряда к массе (независимо от их скорости) в одной и той же точке на экране. В результате последующего использования и усовершенствования масс-спектрометров усилиями многих исследователей к 1935 году была составлена почти полная таблица изотопных составов химических элементов.
Слайд 9Применение изотопов
Разнообразные изотопы химических элементов находят широкое применение в научных
исследованиях, в различных областях промышленности и сельского хозяйства, в ядерной
энергетике, современной биологии и медицине, в исследованиях окружающей среды и других областях. В научных исследованиях требуются небольшие количества редких изотопов различных элементов, исчисляемые граммами и даже миллиграммами в год. Вместе с тем, для ряда изотопов, широко используемых в ядерной энергетике, медицине и других отраслях, потребность в их производстве может составлять многие килограммы и даже тонны. В научных исследованиях стабильные и радиоактивные изотопы широко применяются в качестве изотопных индикаторов при изучении самых различных процессов, происходящих в природе. В сельском хозяйстве изотопы применяются, например, для изучения процессов фотосинтеза, усвояемости удобрений и для определения эффективности использования растениями азота, фосфора, микроэлементов и др. веществ.Слайд 10Изотопные технологии находят широкое применение в медицине. Так в США,
согласно статистическим данным, проводится более 36 тыс. медицинских процедур в
день и около 100 млн. лабораторных тестов с использованием изотопов. Наиболее распространены процедуры, связанные с компьютерной томографией. Изотоп углерода C13, обогащенный до 99% (природное содержание около 1%), активно используется в так называемом «диагностическом контроле дыхания». Суть теста очень проста. Обогащенный изотоп вводится в пищу пациента и после участия в процессе обмена веществ в различных органах тела выделяется в виде выдыхаемого пациентом углекислого газа СО2, который собирается и анализируется с помощью спектрометра. Различие в скоростях процессов, связанных с выделением различных количеств углекислого газа, помеченных изотопом С13, позволяют судить о состоянии различных органов пациента. В США число пациентов, которые будут проходить этот тест, оценивается в 5 млн. человек в год. Сейчас для производства высоко обогащенного изотопа С13 в промышленных масштабах используются лазерные методы разделения.
Теги