Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация к разработке урока по ФГОС. Нитраты - соли азотной кислоты. 9 класс.
Содержание
- 1. Презентация к разработке урока по ФГОС. Нитраты - соли азотной кислоты. 9 класс.
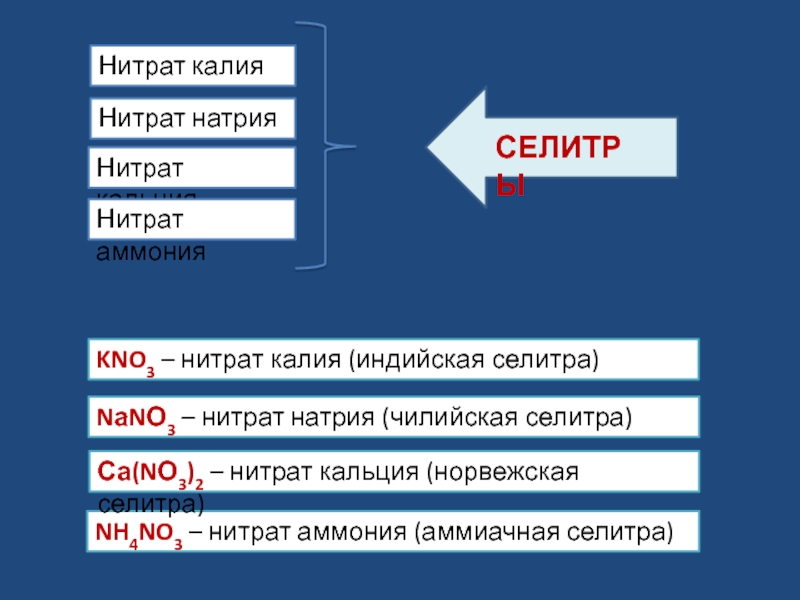
- 2. Me (NO3)n или NH4NO3Состав нитратов
- 3. NH4NO3 – нитрат аммония (аммиачная селитра)KNO3 – нитрат калия (индийская селитра)NаNО3 – нитрат натрия (чилийская селитра) Са(NО3)2 – нитрат кальция (норвежская селитра)
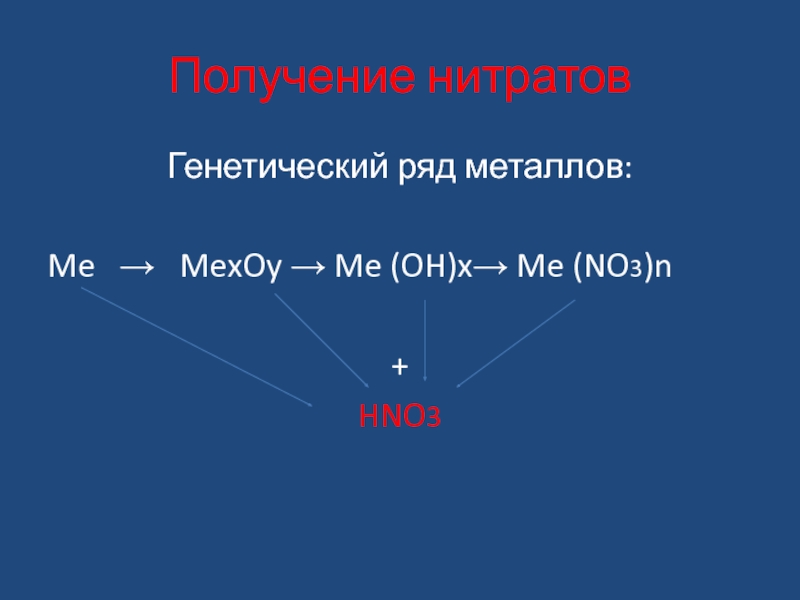
- 4. Получение нитратовГенетический ряд металлов:Me → MexOy → Me (OH)x→ Me (NO3)n+HNO3
- 5. Уравнения реакцийМеталл +
- 6. Физические свойства нитратоврастворение нитратов – эндотермический процесспри
- 7. ХИМИЧЕСКИЕ СВОЙСТВА НИТРАТОВС кислотамиAgNO3 + HCl = AgCl↓ +
- 8. ХИМИЧЕСКИЕ СВОЙСТВА НИТРАТОВВсе нитраты термически неустойчивы. При нагревании они разлагаются с
- 9. Качественная реакция на нитраты
- 10. Слайд 10
- 11. Скачать презентанцию
Me (NO3)n или NH4NO3Состав нитратов
Слайды и текст этой презентации
Слайд 3NH4NO3 – нитрат аммония (аммиачная селитра)
KNO3 – нитрат калия (индийская селитра)
NаNО3 – нитрат натрия (чилийская селитра)
Слайд 5
Уравнения реакций
Металл + Азотная кислота
Cu +
4HNO3(k) = Cu(NO3)2 + 2NO2↑ + 2H2O
Основный оксид + Азотная кислота
CuO
+ 2HNO3 = Cu(NO3)2 + H2OОснование + Азотная кислота
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
Соль слабой кислоты + Азотная кислота
CuCO3+ 2HNO3 = Cu(NO3)2 + CO 2↑ + 2H2O
NH3 + HNO3 =NH4NO3
Слайд 6Физические свойства нитратов
растворение нитратов – эндотермический процесс
при обычных условиях это
твёрдые кристаллические вещества
нитраты хорошо растворимы в воде
Слайд 7ХИМИЧЕСКИЕ СВОЙСТВА НИТРАТОВ
С кислотами
AgNO3 + HCl = AgCl↓ + HNO3
Со щелочами
Cu(NO3)2 + 2NaOH
= Cu(OH)2 ↓ + 2NaNO3
С солями
Cu(NO3)2 + 2NaOH = Cu(OH)2 ↓ + 2NaNO3
Слайд 8ХИМИЧЕСКИЕ СВОЙСТВА НИТРАТОВ
Все нитраты термически неустойчивы. При нагревании они разлагаются с образованием кислорода.
Другие
реакции - от положения металла, образующего нитрат, в электрохимическом ряду
напряжений:Специфические
левее Mg