Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Производство аммиака
Содержание
- 1. Производство аммиака
- 2. Цели работы:Изучить процесс производства аммиакаИзучить условия протекания реакцииИзучить пользу и вред производства
- 3. Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный
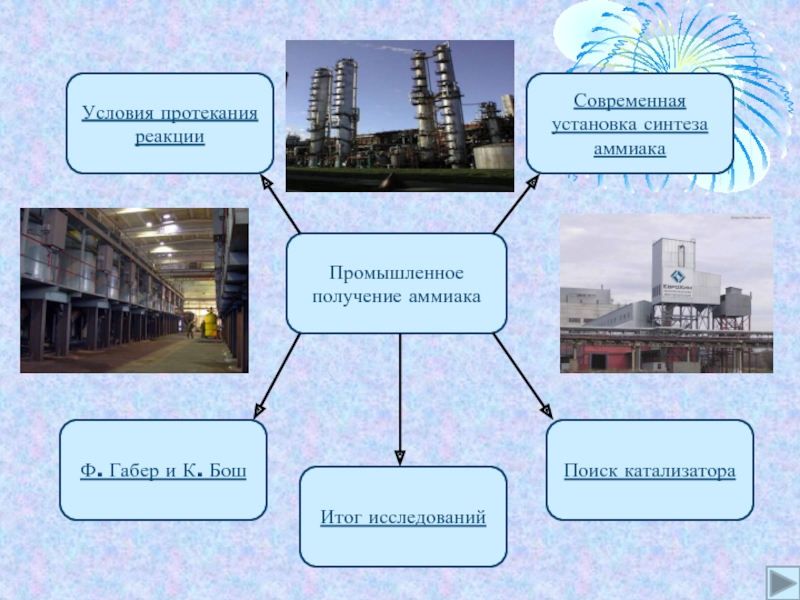
- 4. Промышленное получение аммиакаУсловия протекания реакцииСовременная установка синтеза аммиакаПоиск катализатораИтог исследованийФ. Габер и К. Бош
- 5. Условия протекания реакции: Синтез аммиака из
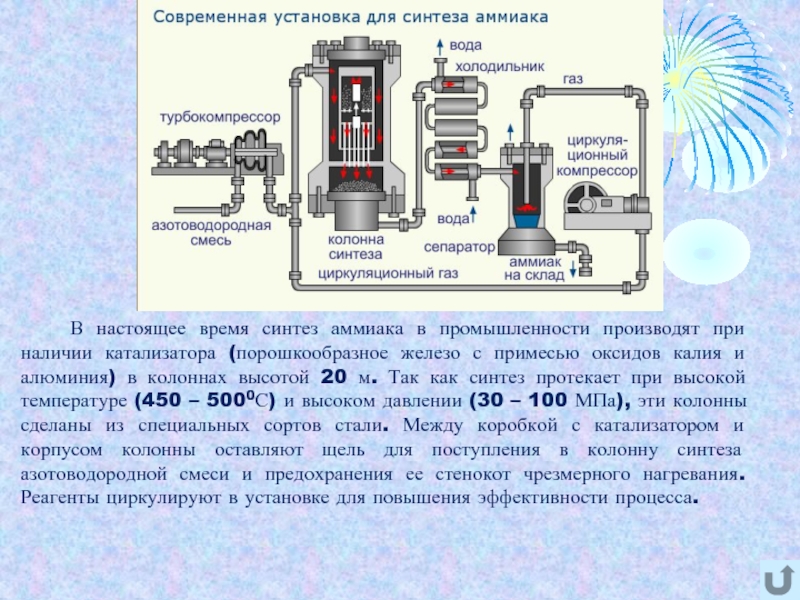
- 6. В настоящее время синтез аммиака
- 7. Разработав технологию получения аммиака прямым синтезом из
- 8. Установка для промышленного производства аммиака,
- 9. В период разработки промышленного
- 10. Аммиак ядовит. ПДК = 20 мг/м3. Жидкий
- 11. Аммиак является конечным продуктом азотистого обмена
- 12. Отравление аммиаком вызывает также сильное возбуждение, вплоть
- 13. Количество аварий, связанных
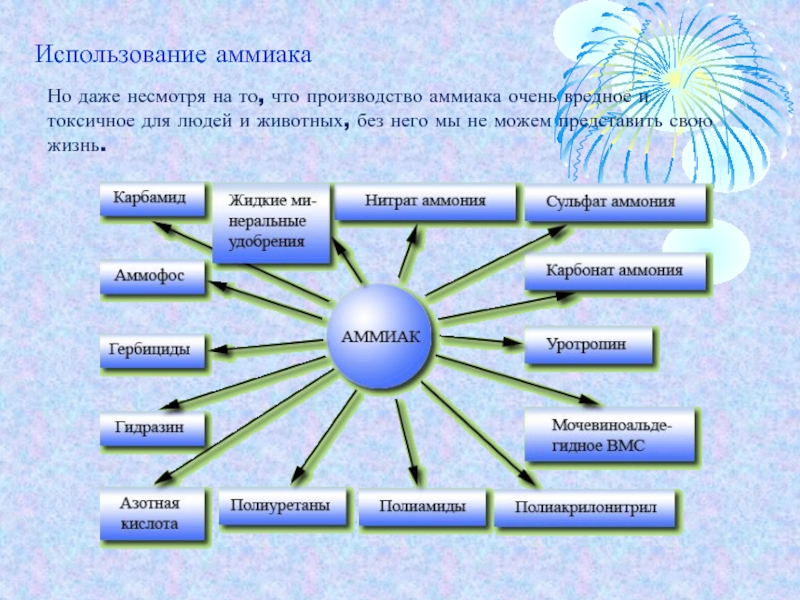
- 14. Но даже несмотря на то, что производство
- 15. Использование аммиака
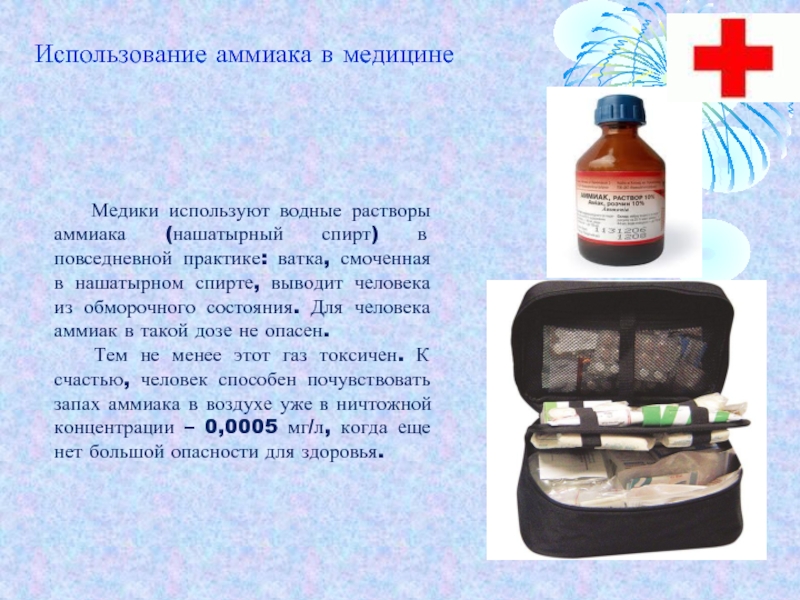
- 16. Медики используют водные растворы аммиака
- 17. Получение и применение аммиака http://www.eor.edu.ru/search.pageФото Габера Ф.
- 18. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Производство аммиака.
Автор: Черникова Ольга,
ученица 8Г класса
МОУ «СОШ №28»
Руководитель: Яковлева О.А.,
учитель химии
Слайд 2Цели работы:
Изучить процесс производства аммиака
Изучить условия протекания реакции
Изучить пользу и
вред производства
Слайд 3 Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким
характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, очень ядовит.
Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.М (NH3) = 17 г/моль
Нашатырный спирт – 10%-ный раствор аммиака
Слайд 4Промышленное получение аммиака
Условия протекания реакции
Современная установка синтеза аммиака
Поиск катализатора
Итог исследований
Ф.
Габер и К. Бош
Слайд 5Условия протекания реакции:
Синтез аммиака из водорода N2 и
водорода H2 – реакция обратимая, экзотермическая, протекает с уменьшением объёма.
Поиски условий синтеза в течение почти всего XIX века носили только экспериментальный характер. Лишь в первом десятилетии XX века физико - химики Шателье, Нернст и Габер Используя учение о химическом равновесии и химической кинетике, теоретически и экспериментально исследовали равновесие аммиака с азотом и водородом в высоком и широком интервале условий. Была изучена и кинетика синтеза.Слайд 6 В настоящее время синтез аммиака в промышленности производят
при наличии катализатора (порошкообразное железо с примесью оксидов калия и
алюминия) в колоннах высотой 20 м. Так как синтез протекает при высокой температуре (450 – 5000С) и высоком давлении (30 – 100 МПа), эти колонны сделаны из специальных сортов стали. Между коробкой с катализатором и корпусом колонны оставляют щель для поступления в колонну синтеза азотоводородной смеси и предохранения ее стенокот чрезмерного нагревания. Реагенты циркулируют в установке для повышения эффективности процесса.Слайд 7 Разработав технологию получения аммиака прямым синтезом из азота и водорода,
немецкие химики Фриц Габер и Карл Бош оказали своему отечеству
неоценимую услугу: хорошо развитая в Германии химическая промышленность далее могла из аммиака получать азотную кислоту и другие соединения азота - от лекарств до взрывчатых веществ.Для страны, не очень богатой минеральными ресурсами, получение аммиака "из воздуха" было решением многих экономических вопросов. Более того, считается, что Германия, блокированная войсками противника, без аммиачного производства Габера и Боша не смогла бы столько времени "продержаться" в первой мировой войне.
Фриц Габер
(1868 – 1934)
Карл Бош
(1874 – 1940)
Слайд 8 Установка для промышленного производства аммиака, разработанная Ф. Габером
и К. Бошем.
Массовое производство аммиака началось в канун первой мировой
войны благодаря К. Бошу, химику – технологу предприятия «BASF». На первых установках синтез проводили под давлением 20 МПа, при температуре 5000C на осмиевом (Оs) катализаторе. А чтобы повысить выход аммиака, было предложено возвращать не прореагировавшею азотоводородную смесь обратно в реакционный аппарат. Итог исследований
В результате исследований Ф. Габеру удалось обобщить сведения об этой реакции и подобрать условия для ее промышленного проведения.
Слайд 9 В период разработки промышленного способа синтеза аммиака
проводились многочисленные исследования в поисках активных катализаторов. Были испытаны тысячи
веществ по принципу «испробовать все вероятное, а также невероятное». Результат оказался удивительным: катализатором оказалось железо, каталитические свойства которого были известны уже сто лет до для реакции разложения аммиака. Точнее не чистое железо, а «активированное», т.е. с примесями оксидов алюминия и калия.Поиск катализатора
Слайд 10Аммиак ядовит. ПДК = 20 мг/м3. Жидкий аммиак вызывает сильные
ожоги. При содержании в воздухе 0,5% по объему аммиак сильно
раздражает слизистые оболочки. При остром отравлении поражаются глаза и дыхательные пути. При хроническом отравлении — расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.Физиологическое действие аммиака на организм человека
Слайд 11 Аммиак является конечным продуктом азотистого обмена в организме человека
и животных. Он образуется при метаболизме белков, аминокислот и других
азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.Биологическая роль аммиака
Слайд 12Отравление аммиаком вызывает также сильное возбуждение, вплоть до буйного бреда, а
последствия могут быть весьма тяжелыми – до снижения интеллекта и
изменения личности. Очевидно, аммиак способен поражать жизненно важные центры, так что при работе с ним надо тщательно соблюдать меры предосторожности.Вред производства аммиака
Внешние признаки отравления аммиаком могут быть весьма необычными.
У пострадавших, например, резко снижается слуховой порог: даже не слишком громкие звуки становятся невыносимы и могут вызвать судороги.
Слайд 13 Количество аварий, связанных с утечкой аммиака,
по отношению к общему количеству систем, невелико. Все происшествия такого
рода, приведшие к смерти, учитываются (в США - последние 11 лет, в Великобритании - с 1986 г., в Швеции - c 1940 г.). Судя по этим данным, шанс в течение года умереть от аммиака есть лишь у двух человек из миллиарда. Для сравнения, по сведениям американских статистиков, вероятность в течение года погибнуть от удара молнии - 32 на миллиард. В результате травм на производстве в Швеции гибнет 5 человек из миллиона, из-за дорожных происшествий - 5 на 100 000.Статистика аварий/несчастных случаев, связанных с использованием аммиака
Слайд 14Но даже несмотря на то, что производство аммиака очень вредное
и токсичное для людей и животных, без него мы не
можем представить свою жизнь.Использование аммиака
Слайд 16 Медики используют водные растворы аммиака (нашатырный спирт) в
повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из
обморочного состояния. Для человека аммиак в такой дозе не опасен.Тем не менее этот газ токсичен. К счастью, человек способен почувствовать запах аммиака в воздухе уже в ничтожной концентрации – 0,0005 мг/л, когда еще нет большой опасности для здоровья.
Использование аммиака в медицине
Слайд 17Получение и применение аммиака http://www.eor.edu.ru/search.page
Фото Габера Ф. http://www.google.ru/imglanding?q=габер&hl=ru&newwindow=1&sa=X&rlz=1C1CHOL_ruRU411RU413&tbs=isch:1&prmd=ivns&tbnid=4RiFWvWihsgWKM:&imgrefurl=http://supotnitskiy.ru/book/book5_kommentarii11
Традиционная схема получения
аммиака из природного газа http://www.newchemistry.ru/letter.php?n_id=4156&cat_id=5&page_id=1
Статистика аварий/несчастных случаев,связанных с использованием
аммиака. http://www.mir-klimata.com/archive/number51/article/15_ammiak/10%аммиак.http://www.google.ru/images?hl=ru&newwindow=1&rlz=1C1CHOL_ruRU411RU413&biw=1440&bih=805&tbs=isch:1&sa=1&q=%D0%BC%D0%B5%D0%B4%D0%B8%D0%BA%D0%B8+%D0%B8+%D0%BD%D0%B0%D1%88%D0%B0%D1%82%D1%8B%D1%80%D0%BD%D1%8B%D0%B9+%D1%81%D0%BF%D0%B8%D1%80%D1%82&aq=f&aqi=&aql=&oq=
Красный крест. http://www.google.ru/images?hl=ru&newwindow=1&rlz=1C1CHOL_ruRU411RU413&biw=1440&bih=805&tbs=isch:1&sa=1&q=%D0%BC%D0%B5%D0%B4%D0%B8%D0%BA%D0%B8+%D0%B8+%D0%BD%D0%B0%D1%88%D0%B0%D1%82%D1%8B%D1%80%D0%BD%D1%8B%D0%B9+%D1%81%D0%BF%D0%B8%D1%80%D1%82&aq=f&aqi=&aql=&oq=
Источники информации: