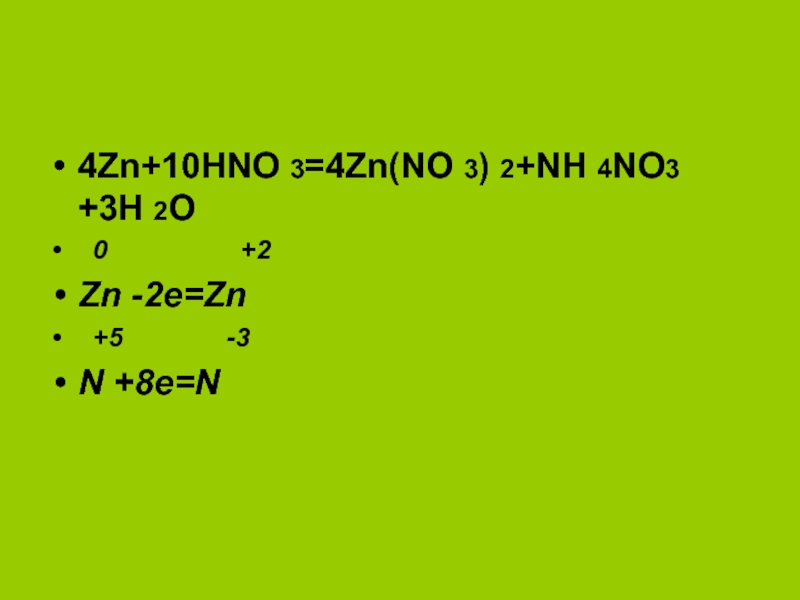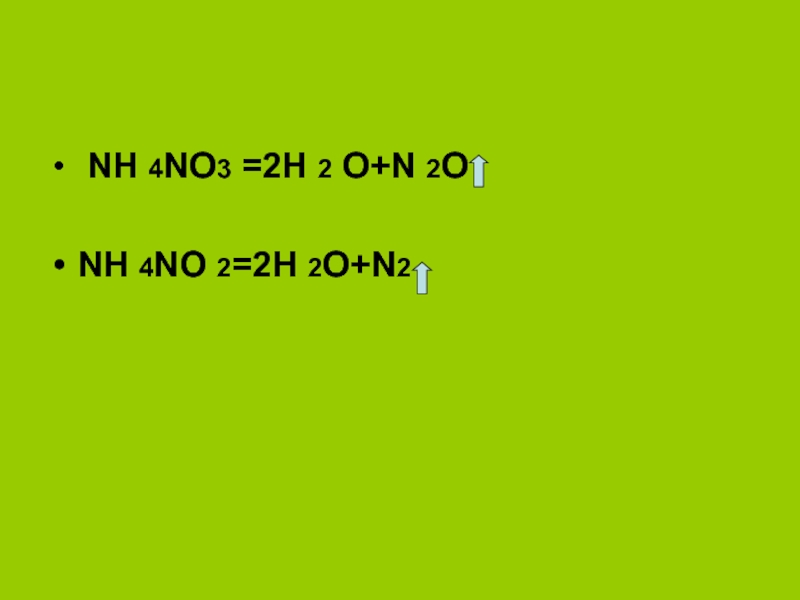химическими свойствами ;
Экспериментально изучить свойства азотной кислоты
Дать представление о качественной
реакции на нитрат – ион;Дать представления о способах получения азотной кислоты в лаборатории и в промышленности;
Экспериментально изучить свойства нитратов.
Цели