CuO.
KOH, Ba(OH)2, Al(OH)3, Cu(OH)2, Fe(OH)3.
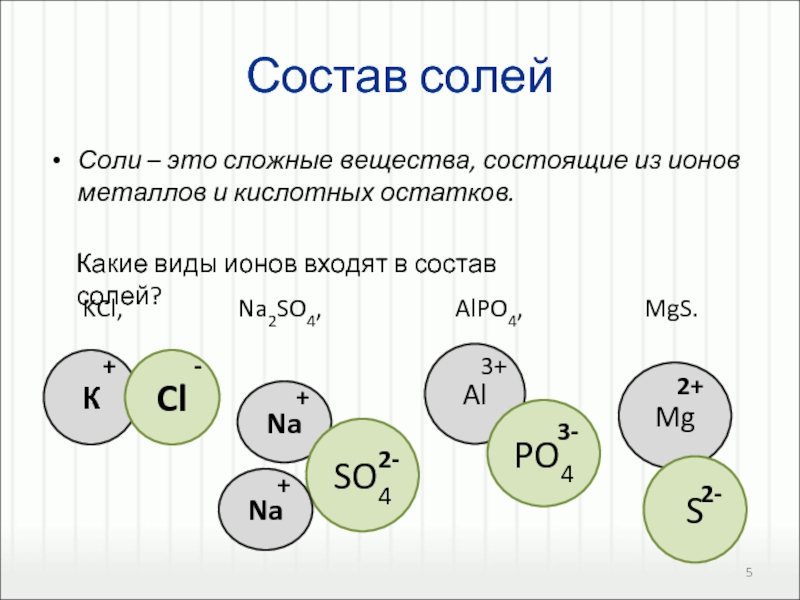
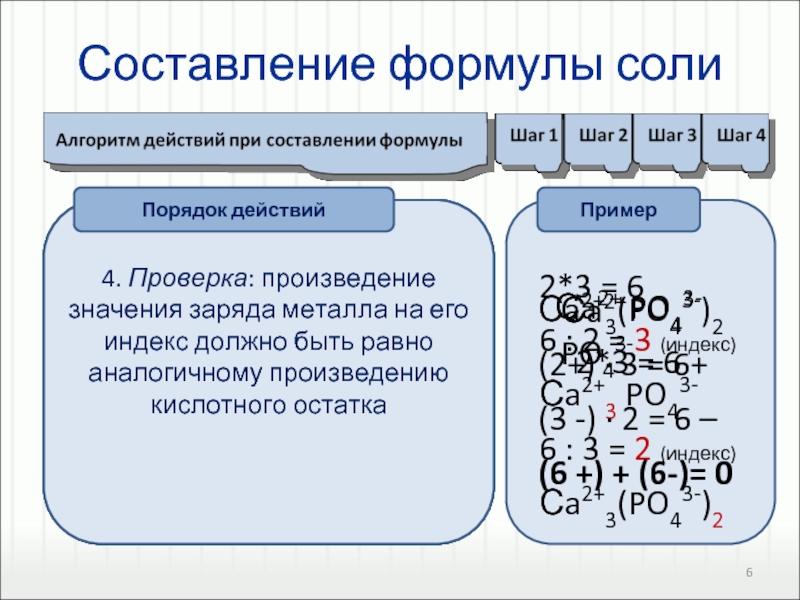
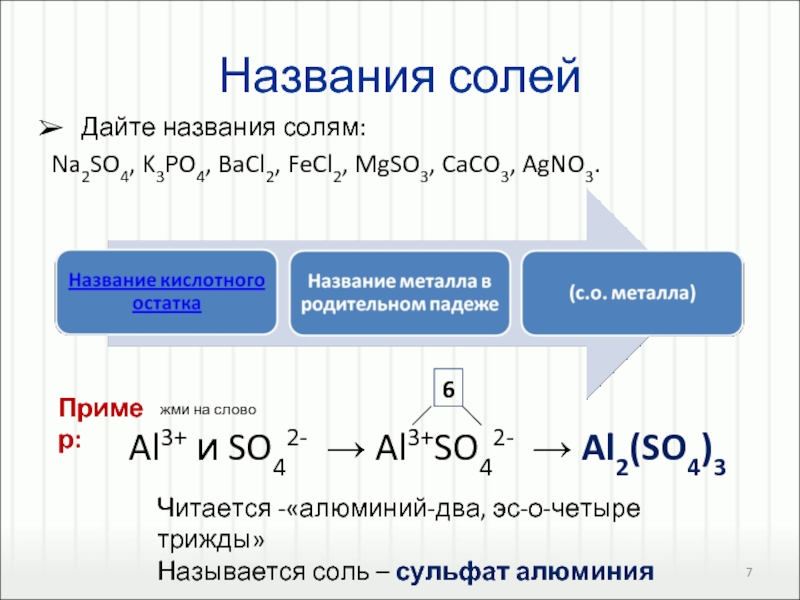
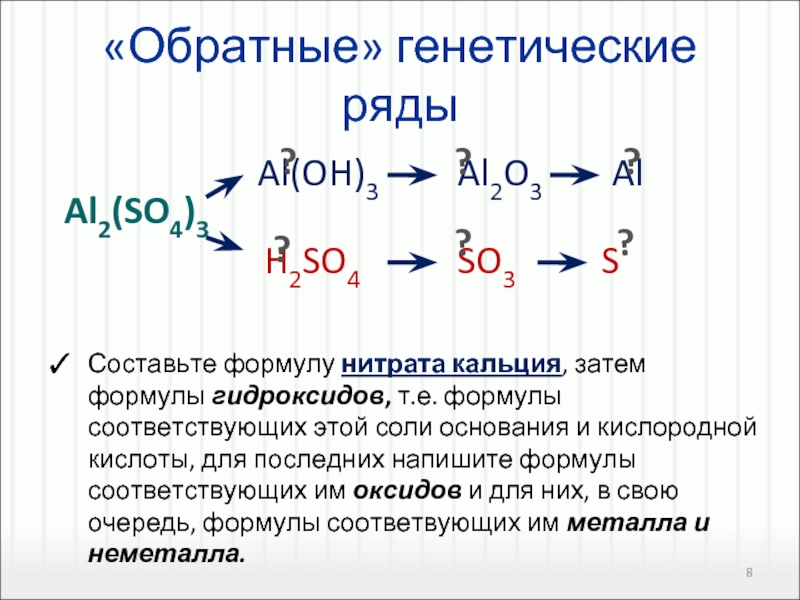
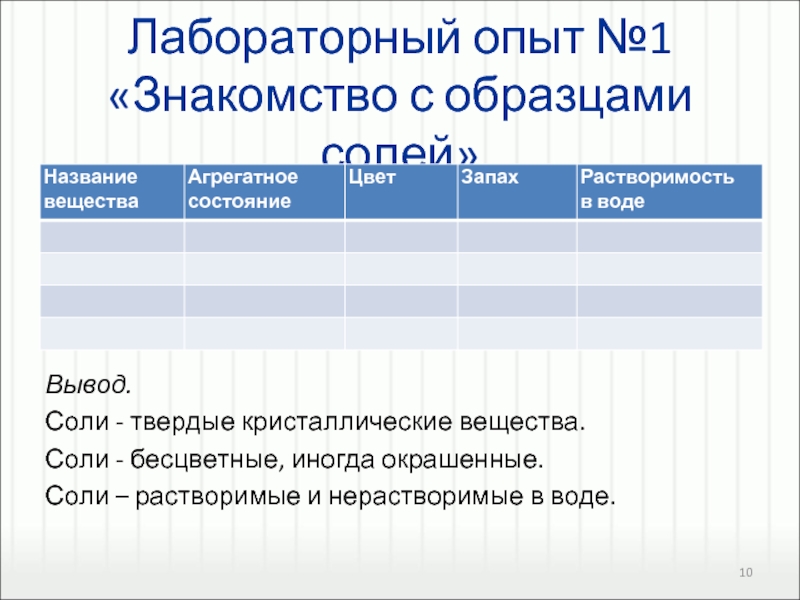
BaСl2, ZnSO4, MgS, Ca(NO3)2.
Назовите каждое вещество.
Определите принадлежность к классам..Что будем изучать сегодня?