Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация к уроку химии "Карбоновые кислоты"
Содержание
- 1. Презентация к уроку химии "Карбоновые кислоты"
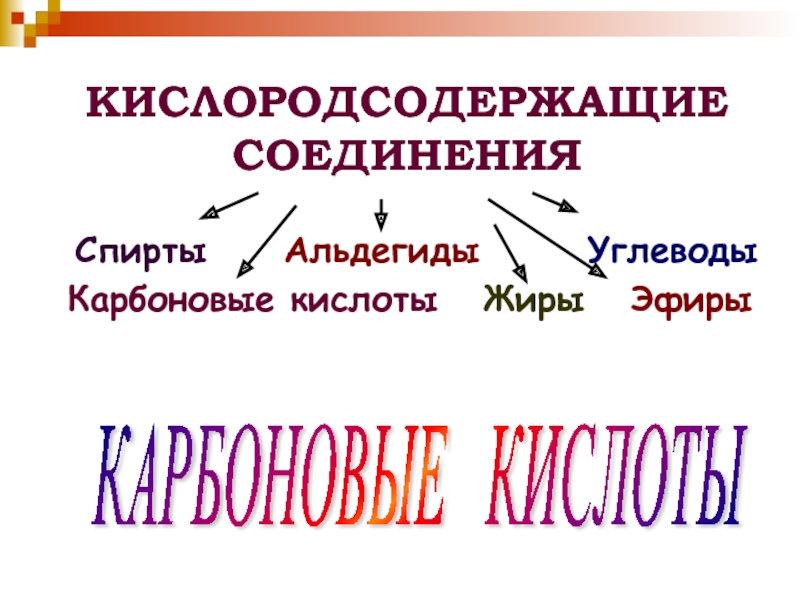
- 2. КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯСпирты Альдегиды
- 3. Карбоновые кислоты – это сложные органические вещества,
- 4. Н – СОН метановая кислотаСН3 – СОН
- 5. Класификация Карбоновые кислоты классифицируют по двум структурным
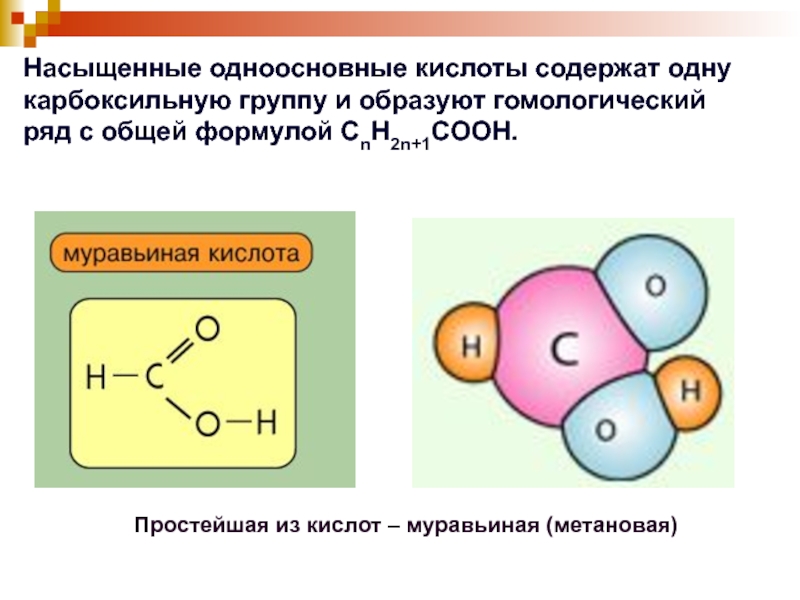
- 6. Простейшая из кислот – муравьиная (метановая)Насыщенные одноосновные
- 7. Слайд 7
- 8. Слайд 8
- 9. 5
- 10. СТРОЕНИЕ 5
- 11. Между молекулами карбоновых кислот образуются водородные связиВодородные
- 12. Химические свойства Реакции замещения водорода в карбоксильной
- 13. В составе муравьиной кислоты можно определить наличие
- 14. Получение
- 15. Вопросы для контроля:Какие вещества называют карбоновыми кислотами,
- 16. Скачать презентанцию
КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯСпирты Альдегиды УглеводыКарбоновые кислоты Жиры ЭфирыКАРБОНОВЫЕ КИСЛОТЫ
Слайды и текст этой презентации
Слайд 3Карбоновые кислоты – это сложные органические вещества, в которых углеводородный
радикал соединён с одной или несколькими карбоксильными группами.
R - СОOH
ОБЩАЯ
ФОРМУЛАR углеводородный радикал
- СООН – карбоксильная группа
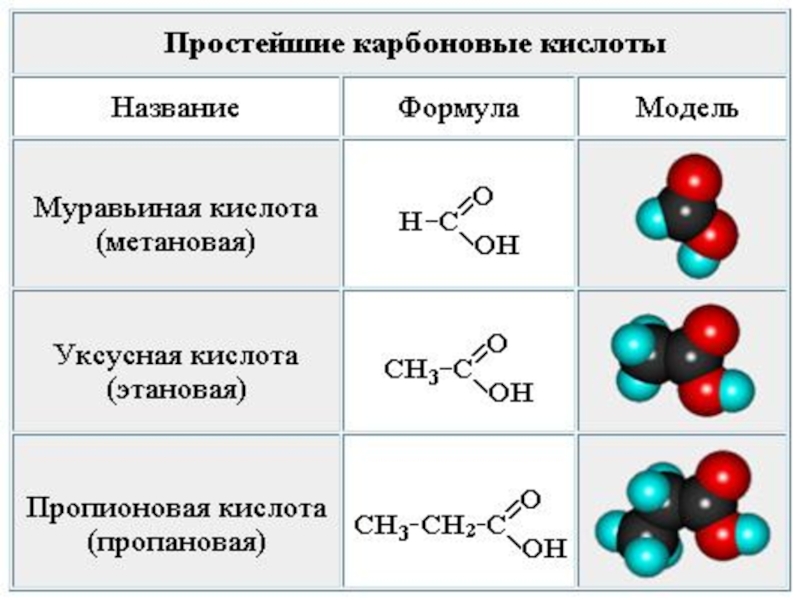
Слайд 4Н – СОН метановая кислота
СН3 – СОН этановая кислота
СН3 –
СН2 – СОН пропановая кислота
R - СОOH
R углеводородный радикал
- СООН
– карбоксильная группаГомологический ряд и номенклатура
Слайд 5Класификация
Карбоновые кислоты классифицируют по двум структурным признакам.
По числу
карбоксильных групп кислоты подразделяются на:
одноосновные
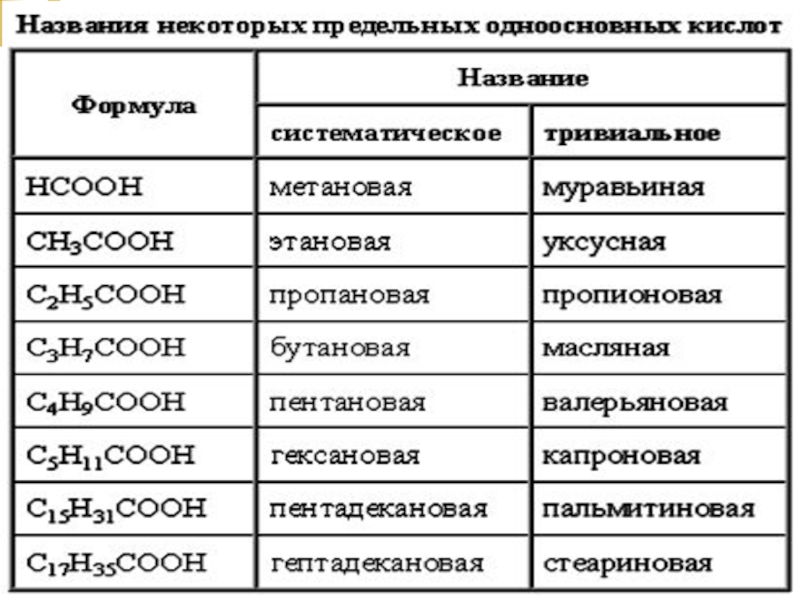
(например: H-COOH – муравьиная кислота,
CH3-COOH – уксусная кислота);
многоосновные (дикарбоновые, трикарбоновые и т.д.), .
По характеру углеводородного радикала различают кислоты:
предельные (например, CH3-CH2-CH2-COOH);
непредельные (CH2= CH-COOH);
ароматические (C6H5 - COOH).
Слайд 6Простейшая из кислот – муравьиная (метановая)
Насыщенные одноосновные кислоты содержат одну
карбоксильную группу и образуют гомологический ряд с общей формулой CnH2n+1COOH.
Слайд 9 5 4
3 2
1СН3 – СН2 – СН2 – СН2 – СООН
Пентановая кислота
4 3 2 1
СН3 – СН – СН2 – СООН
|
СН3
3 – метилбутановая кислота.
4 3 2 1
СН3 – СН2 – СН2 – СОО – СН3
Метиловый эфир бутановой кислоты
ВИДЫ ИЗОМЕРИИ?
Изомерия кислот и номенклатура
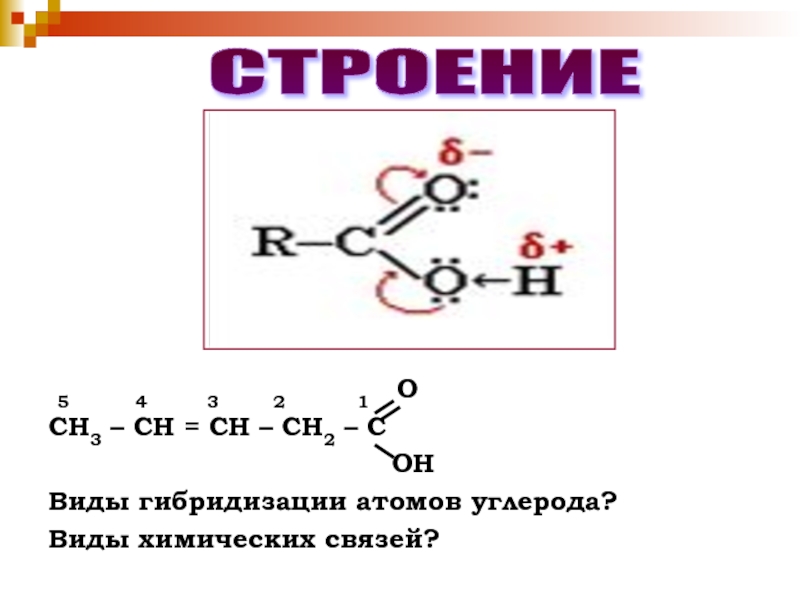
Слайд 10СТРОЕНИЕ
5 4
3 2
1 ОСН3 – СН = СН – СН2 – С
ОН
Виды гибридизации атомов углерода?
Виды химических связей?
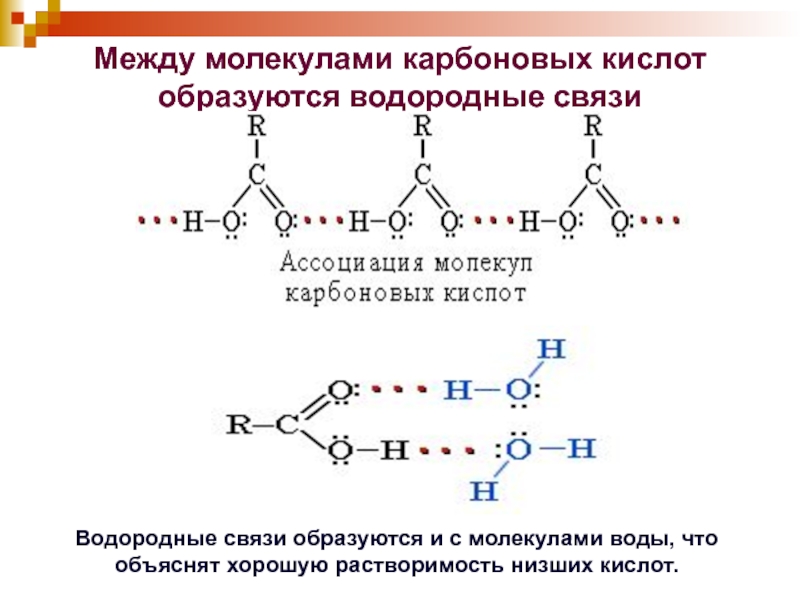
Слайд 11Между молекулами карбоновых кислот образуются водородные связи
Водородные связи образуются и
с молекулами воды, что объяснят хорошую растворимость низших кислот.
Слайд 12Химические свойства
Реакции замещения водорода в карбоксильной группе
1. Диссоциация
СН3 – СН2 – СООН → СН3 – СН2
– СОО- + Н+2. + Ме
2СН3 – СН2 – СООН + 2Na → 2СН3 – СН2 – СООNa + Н2
3. + МеxOy
2СН3 – СН2 – СООН + CaO → (СН3 – СН2 – СОО)2Ca+ Н2O
4. + Ме(OH)y
СН3 – СН2 – СООН + NaOH → СН3 – СН2 – СООNa+ Н2O
5. + МеxAy
2СН3 – СН2 – СООН + Na2CO3 → 2СН3 – СН2 – СООNa+ Н2O + CO2
6. + R- OH (реация этерификации) (Н2CO3)
СН3 – СН2 – СООН + ОН - С2Н5 → СН3 – СН2 – СОО - С2Н5 + Н2О
7. Реакции присоединения
СН2 = СН – СООН + Н2 → СН3 – СН2 – СООН
8. Реакции замещения (с галогенами)
СН3 – СН2 – СООН + Br2 → СН3 – СНBr – СООН + HBr
Слайд 13В составе муравьиной кислоты можно определить наличие не только карбоксильной
группы, но и альдегидной. Поэтому данная кислота проявляет свойства альдегидов,
в частности – реакции окисления(«серебряного зеркала»).
О
Н – С
ОН
Слайд 14Получение
[O] [O]
1. СН3 – СН2 –ОН → СН3 – СОН → СН3 – СООН
Спирт Альдегид Карбоновая кислота
2. Соль карбоновой кислоты + кислота
СН3 – СООNa + Н2SO4 → СН3 – СООH +Na2SO4
3. Гидролиз сложных эфиров
СН3–СН2–СОО -С2Н5 + Н2О→СН3–СН2–СООН + ОН-С2Н5
Слайд 15Вопросы для контроля:
Какие вещества называют карбоновыми кислотами, какова их классификация?
Виды
изомерии карбоновых кислот?
Почему в ряду карбоновых кислот отсутствуют газообразные вещества?
Чем
химические свойства карбоновых кислот схожи со свойствами неорганических кислот?Как получают карбоновые кислоты в лаборатории и промышленности?
Где применяются карбоновые кислоты?