Состав. Строение. Свойства.
2. Получение азота:
А) в лаборатории;Б) в промышленности.
3. Химические свойства.
4. Применение азота
VI. Тест
Азот
3. Нахождение в природе
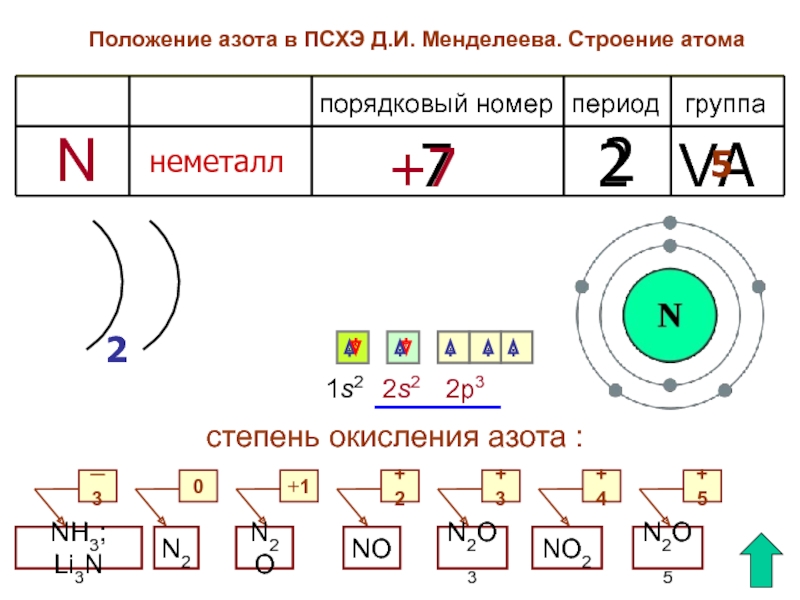
III. Азот – химический элемент:
Положение азота в ПСХЭ Д.И.Менделеева.
Строение атома.
II.Общая характеристика элементов подгруппы азота.
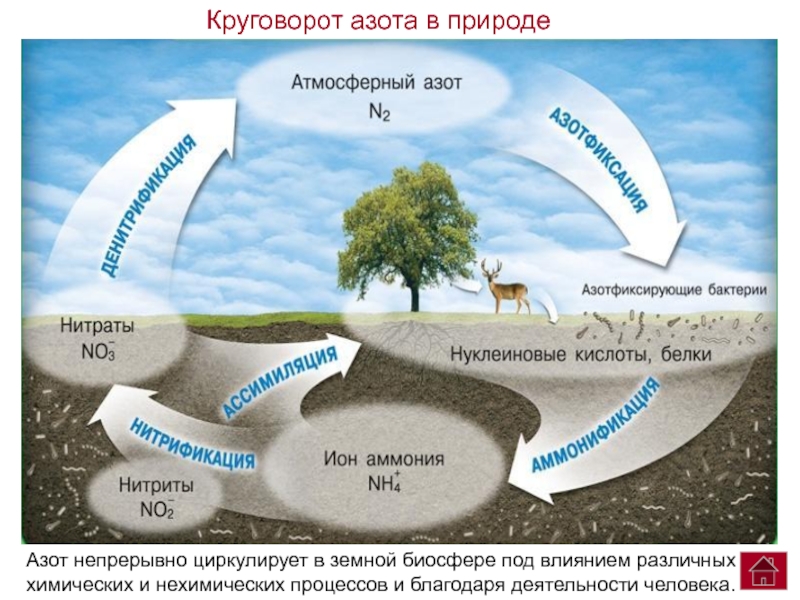
V. Круговорот азота в природе