Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Азотная кислота и ее соли
Содержание
- 1. Азотная кислота и ее соли
- 2. План изучения азотной кислоты. 1.Состав .2.Строение.3.Физические свойства.4.Химические свойства.5.Получение и применение.
- 3. Состав и строение азотной кислоты. -Запишите
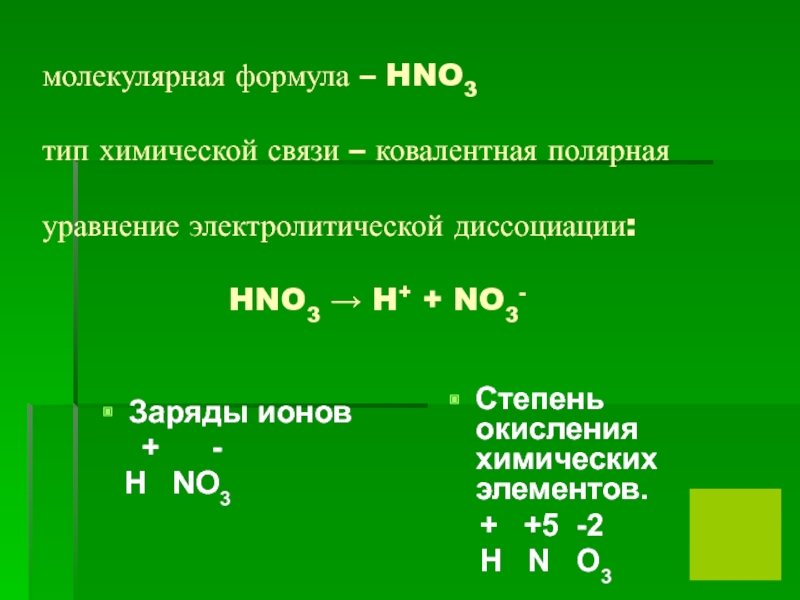
- 4. молекулярная формула – HNO3 тип химической
- 5. Перечислите физические свойства азотной кислоты? Что надо
- 6. Физические свойства. Азотная кислота – это бесцветная
- 7. HNO3 является сильным окислителем.Азотная кислота проявляет все
- 8. HNO3→H+ + NO3- 2HNO3+CuO→Cu(NO3)2+H2O HNO3+NaOH→NaNO3+H2O 2HNO3+Cu(OH)2→Cu(NO3)2+2H2O 2HNO3+Na2CO3→2NaNO3+CO2+H2O
- 9. Ни один из металлов не вытесняет из
- 10. Получение азотной кислоты.Предложите две цепочки превращений, приводящих к получению азотной кислоты, исходя из азота и аммиака.
- 11. §24,с.143,145; §25,с.150; §27,с.156,статья «Оксиды».
- 12. Применение азотной кислоты.§27, с.157 4 абзац.Где находит применение азотная кислота?
- 13. ДОМАШНЕЕ ЗАДАНИЕ.§27, статья «Соли азотной кислоты».? 3 и 7
- 14. Скачать презентанцию
План изучения азотной кислоты. 1.Состав .2.Строение.3.Физические свойства.4.Химические свойства.5.Получение и применение.
Слайды и текст этой презентации
Слайд 2План изучения азотной кислоты.
1.Состав .
2.Строение.
3.Физические свойства.
4.Химические свойства.
5.Получение и применение.
Слайд 3 Состав и строение азотной кислоты. -Запишите молекулярную, электронную, структурную формулы азотной
кислоты. - Укажите тип химической связи в молекуле азотной кислоты. -Расставьте
заряды ионов и степени окисления химических элементов. -Составьте уравнение электролитической диссоциации .Слайд 4молекулярная формула – HNO3 тип химической связи – ковалентная полярная уравнение электролитической
диссоциации: HNO3
→ H+ + NO3-Заряды ионов
+ -
H NO3
Степень окисления химических элементов.
+ +5 -2
H N O3
Слайд 5Перечислите физические свойства азотной кислоты? Что надо сделать при попадании на
кожу азотной кислоты? Как правильно хранить азотную кислоту? На каком свойстве азотной
кислоты это основано?Слайд 6Физические свойства. Азотная кислота – это бесцветная жидкость, имеет резкий запах,
легко испаряется, кипит при t 830. При попадании на кожу может
вызывать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой NaHCO3).С водой смешивается в любых соотношениях. Обычно применяемая в лаборатории азотная кислота содержит 63% HNO3 и имеет плотность 1,4 г/см3 . При хранении довольно легко, особенно на свету, разлагается по уравнению: 4HNO3→2H2O+ 4NO2↑ + O2↑ Выделяющийся газ NO2 окрашивает азотную кислоту в бурый цвет.Слайд 7HNO3 является сильным окислителем.
Азотная кислота проявляет все типичные свойства сильных
кислот: взаимодействует с оксидами и гидроксидами металлов, с солями (составьте
соответствующие уравнения реакций).С металлами она ведет себя по –особому – ни один из металлов не вытесняет из азотной кислоты водород, независимо от ее концентрации.
Почему азотная кислота является сильным окислителем?
Слайд 8HNO3→H+ + NO3-
2HNO3+CuO→Cu(NO3)2+H2O
HNO3+NaOH→NaNO3+H2O
2HNO3+Cu(OH)2→Cu(NO3)2+2H2O
2HNO3+Na2CO3→2NaNO3+CO2+H2O
Слайд 9Ни один из металлов не вытесняет из азотной кислоты водород.
Продукт
восстановления зависит от положения металлов в ряду напряжений, от концентрации
кислоты и условий проведения реакции.Например, при взаимодействии с медью концентрированная кислота восстанавливается до оксида азота(IV):
Cu+HNO3→Cu(NO3)2+NO2+H2O?
разбавленная – до оксида азота(ΙΙ):
Cu+HNO3→Cu(NO3)2+NO+H2O (расставьте коэффициенты методом электронного баланса).
Железо и алюминий при действии концентрированной HNO3 покрываются прочной оксидной пленкой, предохраняющей металл от дальнейшего окисления, т.е. кислота пассивирует их.
В чем особенность реакций между металлами и азотной кислотой? Почему азотную кислоту, можно перевозить в стальных и алюминиевых баллонах?