Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
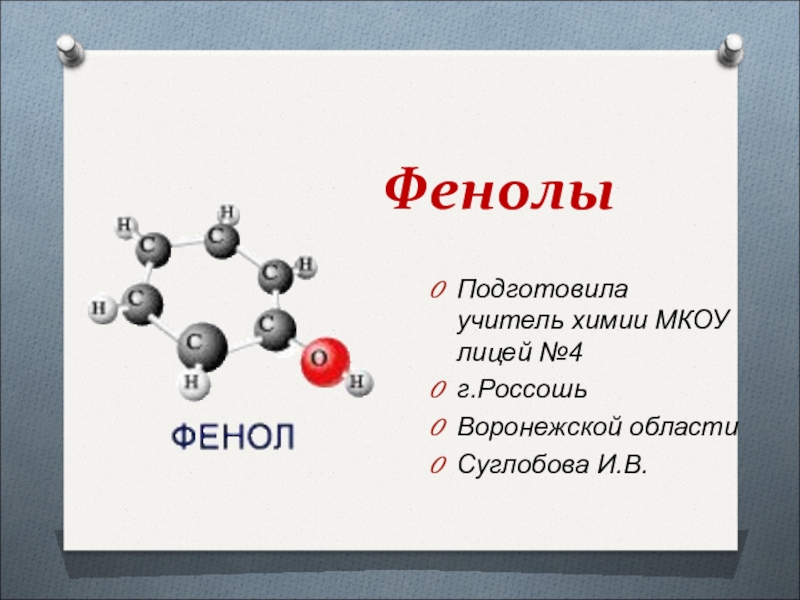
Фенол и его соединения
Содержание
- 1. Фенол и его соединения
- 2. Чаепитие
- 3. Л.Н.Толстой и А.П.Чехов
- 4. Живопись
- 5. Фенолфталеин
- 6. Адреналин
- 7. Фенолы органические гидроксосоединения, молекулы которых состоят
- 8. Общая формула фенолов
- 9. Слайд 9
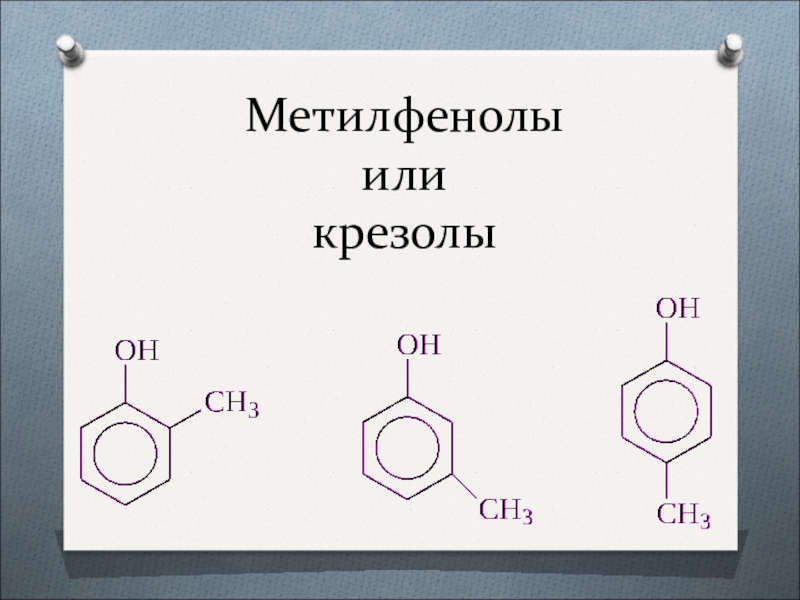
- 10. Метилфенолы или крезолы
- 11. Классификация феноловФенолы классифицируют по атомности, т.е. по
- 12. Слайд 12
- 13. НоменклатураПри составлении названия фенолов нумерация атомов углерода
- 14. Слайд 14
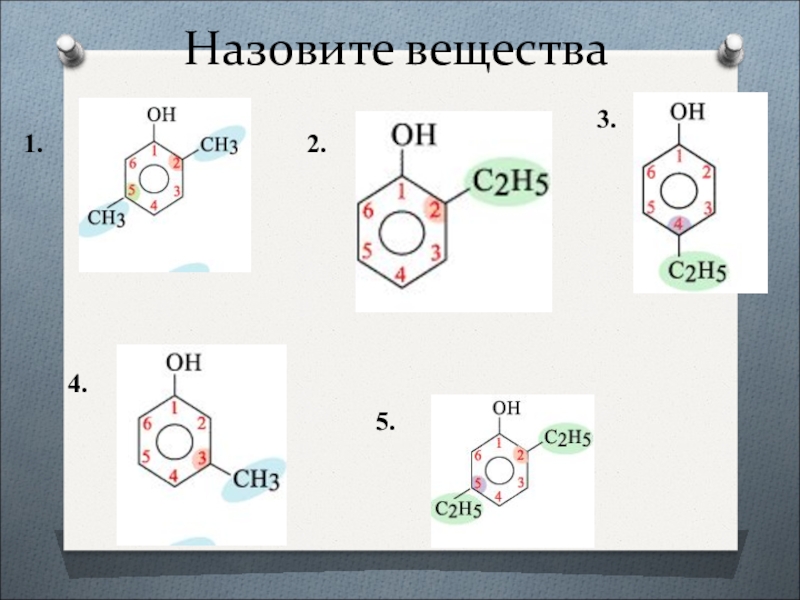
- 15. Назовите вещества1.2.3.4.5.
- 16. Изомерия феноловИзомерия положения заместителей.Изомерия углеродной цепи УВ - радикала
- 17. Построить все возможные изомеры для вещества составом С8Н10О назвать их.
- 18. Как строение фенола связано со строением бензола и спиртов?
- 19. Строение молекулы фенола
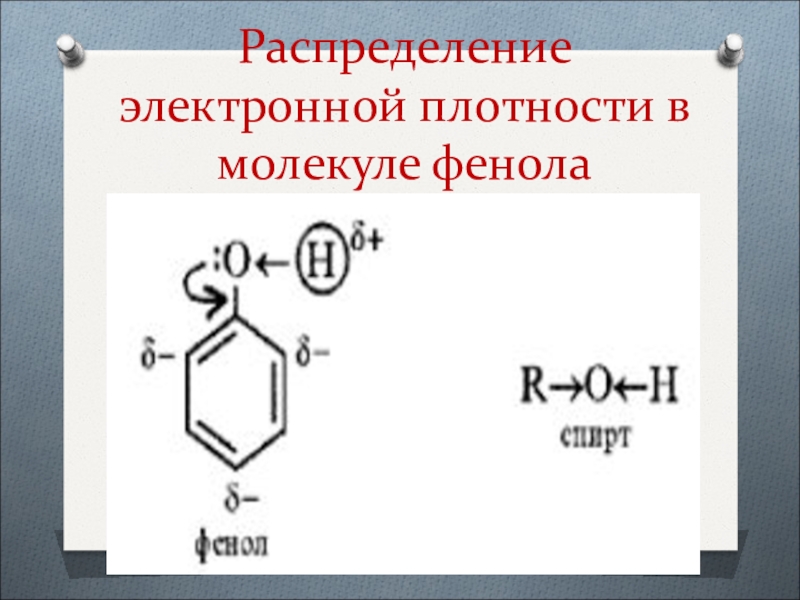
- 20. Распределение электронной плотности в молекуле фенола
- 21. Влияние гидроксогруппы на бензольное кольцоСуть влияния заключается
- 22. Влияние бензольного кольца на гидроксогруппуСуть влияния заключается
- 23. Упражнения для улучшения мозгового кровообращения «Наклоны головы»Вперед – назадВправо - влево
- 24. Упражнение для снятия напряжения с мышц туловища «Наклоны в сторону»
- 25. «Вращение глазами»по часовой стрелке против часовой стрелкиУпражнения для глаз
- 26. Получение фенолаИз каменноугольной смолы.Кумольный способ.Прямой синтез из
- 27. Физические свойства фенолаФенол – это тонкие длинные
- 28. Ядовит! 10-15 г внутрь смертельная доза, на
- 29. «Пальчик»Приближайте и отводите палец
- 30. «Во все стороны»Двигайте глазами вверх-внизвправо-влево
- 31. «Кто там?»Зажмурьтесь посильнееШироко откройте глаза
- 32. Химические свойства фенолаХимические свойства фенола обусловлены наличием в его молекулегидроксильной группыбензольного ядра
- 33. Химические свойства, обусловленные наличием бензольного ядра Реакции
- 34. Б. Нитрование фенола - Нитрование фенола также происходит легче, чем нитрование бензола.
- 35. В результате полного нитрования фенола образуется 2,4,6-тринитрофенол (пикриновая кислота) – взрывчатое вещество.
- 36. В.Реакции гидроксиметилирования с метаналем (формальдегидом) – продукты этой реакции подвергают поликонденсации и получают фенолоформальдегидные смолы
- 37. Химические свойства, обусловленные наличием гидроксильной группы1. Диссоциация фенола – слабая кислота.
- 38. 2.Взаимодействие с натриемФенол, как и спирты, взаимодействует
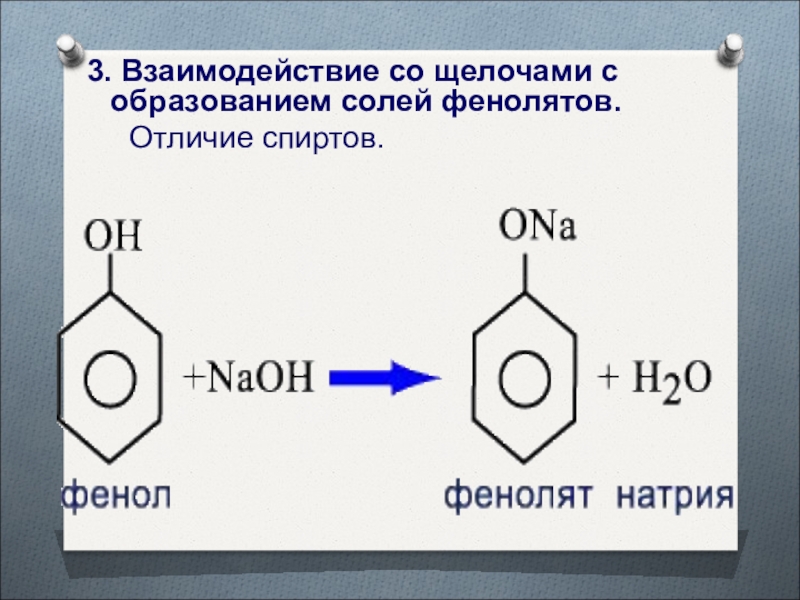
- 39. 3. Взаимодействие со щелочами с образованием солей фенолятов. Отличие спиртов.
- 40. Соли фенола Карболовая кислота
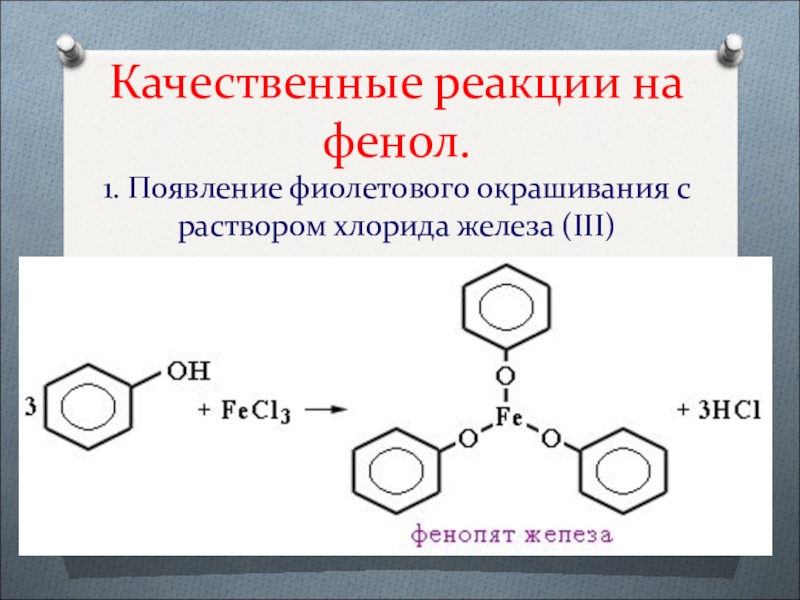
- 41. Качественные реакции на фенол. 1. Появление фиолетового окрашивания с раствором хлорида железа (III)
- 42. 2. Выпадение белого осадка с бромной водой.
- 43. Скачать презентанцию
Чаепитие
Слайды и текст этой презентации
Слайд 7Фенолы органические гидроксосоединения, молекулы которых состоят из бензольного кольца, напрямую
связанного с одной или несколькими гидроксогруппами.
Слайд 11Классификация фенолов
Фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу
Двухатомные фенолы содержат
две гидроксильные группы Трёхатомные фенолы содержат три гидроксильные группы
Слайд 13Номенклатура
При составлении названия фенолов нумерация атомов углерода в бензольном ядре
начинается с атома непосредственно связанного с гидроксильной группой .
Затем
называются заместители в алфавитном порядке с указанием номера атома углерода, при котором они находятся.Слайд 21Влияние гидроксогруппы на бензольное кольцо
Суть влияния заключается в том, что
атом кислорода гидроксогруппы, как более электроотрицательный, а также обладающий неподелённой
парой электронов вступает в сопряжение с π-электронами бензольного кольца.В результате электронная плотность усиливается в орто – и пара – положениях бензольного кольца или в положениях 2,4,6.
Слайд 22Влияние бензольного кольца на гидроксогруппу
Суть влияния заключается в том, что
из за оттягивания электронной плотности связь С – О укорачивается
и становится более прочной, поэтому фенолу не характерны реакции замещения гидроксогруппы в отличие от спиртов.Связь О – Н удлиняется и становится менее прочной, поэтому фенол проявляет более сильные кислотные свойства, чем спирты. Он способен реагировать не только с активными металлами, но и с гидроксидами.
Слайд 23Упражнения для улучшения мозгового кровообращения
«Наклоны головы»
Вперед – назад
Вправо -
влево
Слайд 26Получение фенола
Из каменноугольной смолы.
Кумольный способ.
Прямой синтез из бензола – каталитическое
окисление перекисью водорода.
Реакция галогенбензола с водным раствором щелочи.
Нагревание солей аренсульфокислот
со щелочами.Слайд 27Физические свойства фенола
Фенол – это тонкие длинные игольчатые кристаллы или
бесцветная кристаллическая масса со своеобразным запахом, на воздухе розовеет из
за окисления.В холодной воде растворим плохо, а в горячей не ограниченно
Слайд 28Ядовит! 10-15 г внутрь смертельная доза, на коже вызывает ожоги.
Всасывается через кожу и слизистые и оседает во всех органах.
Опасен для животных и человека не только фенол, но и его соединения.
Слайд 32Химические свойства фенола
Химические свойства фенола обусловлены наличием в его молекуле
гидроксильной
группы
бензольного ядра
Слайд 33Химические свойства, обусловленные наличием бензольного ядра
Реакции замещения.
А. Галогенирование – для фенола характерны реакции замещения с галогенами.
Они проходят значительно легче, чем реакции замещения бензола.Слайд 35 В результате полного нитрования фенола образуется
2,4,6-тринитрофенол
(пикриновая кислота) – взрывчатое вещество.
Слайд 36В.Реакции гидроксиметилирования с метаналем (формальдегидом) – продукты этой реакции подвергают
поликонденсации и получают фенолоформальдегидные смолы
Слайд 37Химические свойства, обусловленные наличием гидроксильной группы
1. Диссоциация фенола – слабая
кислота.
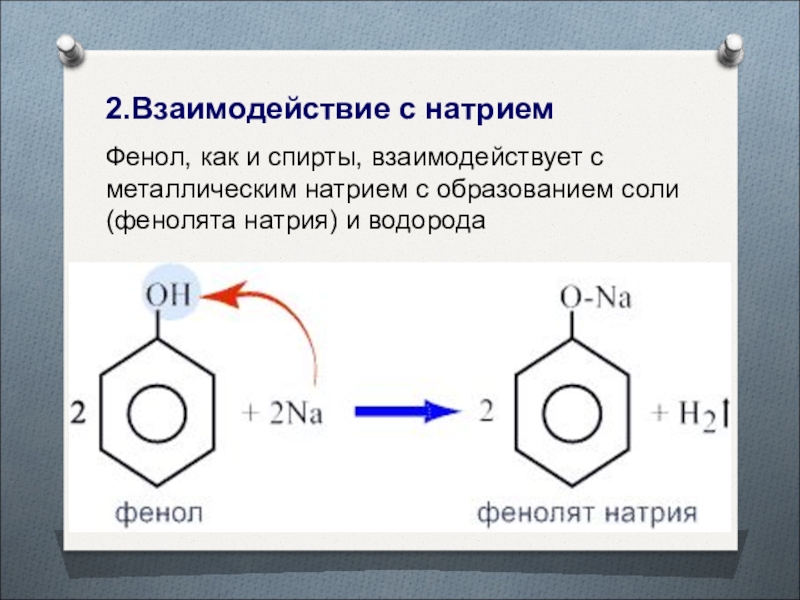
Слайд 382.Взаимодействие с натрием
Фенол, как и спирты, взаимодействует с металлическим натрием
с образованием соли (фенолята натрия) и водорода
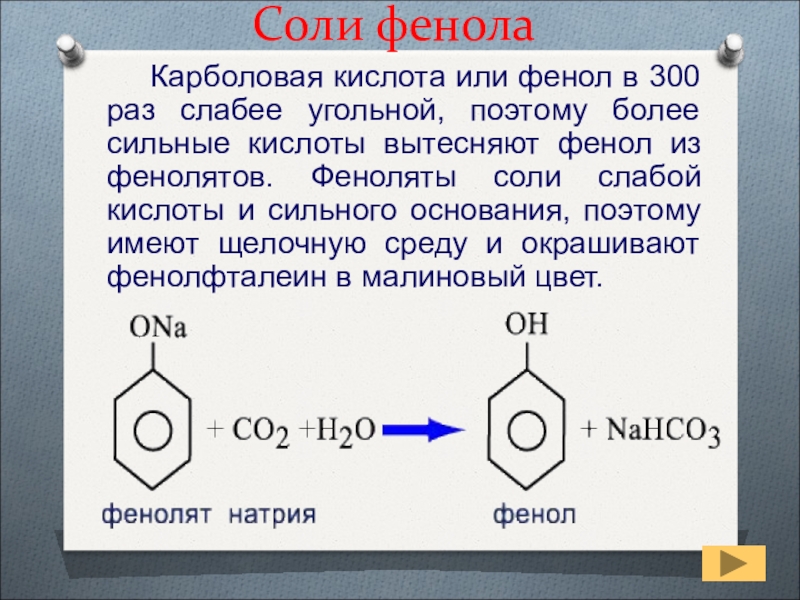
Слайд 40Соли фенола
Карболовая кислота или фенол в
300 раз слабее угольной, поэтому более сильные кислоты вытесняют фенол
из фенолятов. Феноляты соли слабой кислоты и сильного основания, поэтому имеют щелочную среду и окрашивают фенолфталеин в малиновый цвет.