Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фосфор
Содержание
- 1. Фосфор
- 2. План урока1)СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА АТОМОВ ФОСФОРА И АЗОТА;2)ФОСФОР,
- 3. 1)Составьте сравнительную характеристику фосфора и азота, заполнив таблицу.
- 4. 2)СРАВНИТЕ СВОЙСТВА АТОМА ФОСФОРА СО СВОЙСТВАМИ ЭЛЕМЕНТОВ,
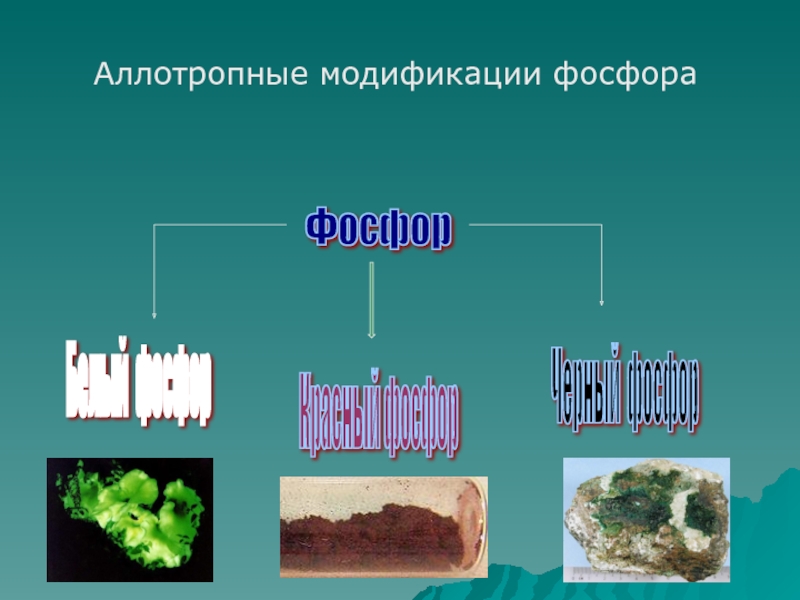
- 5. Фосфор Белый фосфор Красный фосфор Черный фосфор Аллотропные модификации фосфора
- 6. Белый фосфорНаиболее распространен белый, или желтый, фосфор.
- 7. Красный фосфорАморфный темно-малиновый порошок без запаха. Менее
- 8. Черный фосфорРомбическая модификацияКубическая модификацияИмеет атомную кристаллическую решетку.
- 9. «Да! Это была собака, огромная, черная как
- 10. 3)ИСТОРИЯ ОТКРЫТИЯ ФОСФОРА Свое название фосфор получил
- 11. К.В. Шееле (1742–1786) Вскоре Ю.
- 12. 4)ПОЛУЧЕНИЕ ФОСФОРА;Свободный фосфор получают в электрических печах
- 13. 5)ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРАА) Взаимодействие с кислородом: Р +
- 14. 6)НАХОЖДЕНИЕ В ПРИРОДЕФосфор встречается в природе только
- 15. 7)ПРИМЕНЕНИЕ ФОСФОРАБолее половины объема мирового производства фосфора
- 16. Я светоносный элемент. Я спичку вам зажгу в
- 17. Что мы узнали о фосфоре?
- 18. Домашнее задание§ 21, повторить § 15 и 16.Упр. 2-4, стр. 70, задания в тетради.
- 19. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2План урока
1)СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА АТОМОВ ФОСФОРА И АЗОТА;
2)ФОСФОР, КАК ПРОСТОЕ ВЕЩЕСТВО
;АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ФОСФОРА;
ФОСФОРА.Слайд 42)СРАВНИТЕ СВОЙСТВА АТОМА ФОСФОРА СО СВОЙСТВАМИ ЭЛЕМЕНТОВ, СТОЯЩИМИ РЯДОМ В
ПЕРИОДЕ И ПОДГРУППЕ.
N
Si P S
As
Слайд 6Белый фосфор
Наиболее распространен белый, или желтый, фосфор. Белый фосфор имеет
молекулярную решетку, в узлах которой находятся тетраэдрические молекулы Р4.
Это очень реакционноспособное, мягкое воскообразное вещество бледно-желтого цвета, с неприятным чесночным запахом, растворимое в сероуглероде и бензоле, нерастворимое в воде. Очень ядовит. Воспламеняется при трении, обладает уникальной способностью светиться в темноте за счет медленного окисления.
Температура плавления – 44оС. В лаборатории его хранят под слоем воды. Смертельная доза– 0,1 г.При нагревании без доступа воздуха до 250-300 градусов белый фосфор превращается в красный.
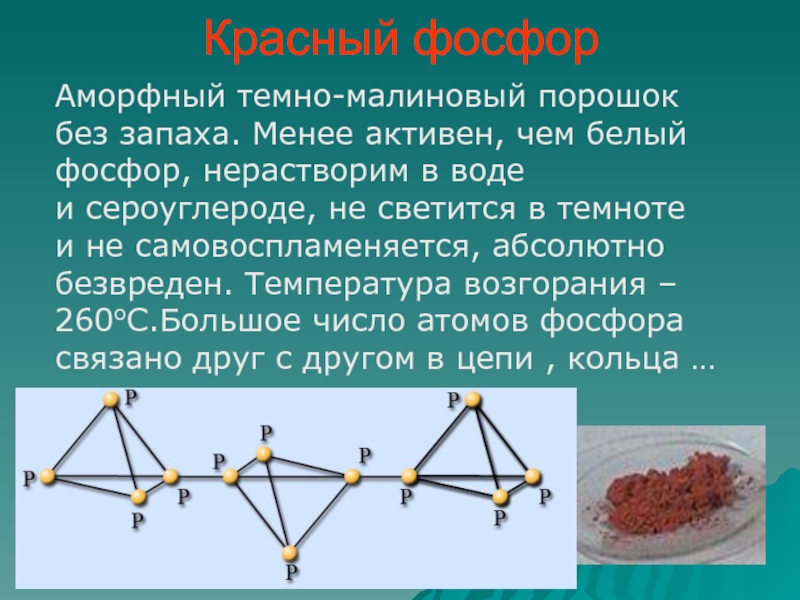
Слайд 7Красный фосфор
Аморфный темно-малиновый порошок без запаха. Менее активен, чем белый
фосфор, нерастворим в воде и сероуглероде, не светится в темноте
и не самовоспламеняется, абсолютно безвреден. Температура возгорания – 260оС.Большое число атомов фосфора связано друг с другом в цепи , кольца …Слайд 8Черный фосфор
Ромбическая модификация
Кубическая модификация
Имеет атомную кристаллическую решетку.
По внешним признакам
черный фосфор напоминает графит, имеет металлический блеск, обладает электропроводностью и
теплопроводностью, довольно твердый.Наименее активный из всех модификаций.
Слайд 9«Да! Это была собака, огромная, черная как смоль… Из ее
отверстой пасти вырывалось пламя, глаза метали искры, по морде и
загривку переливался мерцающий огонь.»Слайд 103)ИСТОРИЯ ОТКРЫТИЯ ФОСФОРА
Свое название фосфор получил
за способность светиться
в темноте
(греч. фосфор означает «светоносный»).
В поисках философского камня ,
якобы способного превратить неблагородные металлы в золото ,гамбургский алхимик Г.Бранд в 1669г.при перегонке сухого остатка от выпаривании мочи впервые получил белый фосфор .Светоносный элемент принес Бранду немало денег (он показывал белый фосфор богатым людям за вознаграждение ).Позже Бранд продает секреты своего открытия дрезденскому алхимику Крафту .Изготовив достаточное количество фосфора, Крафт отправился в длительный вояж по Европе , где с большим успехом демонстрировал его свойства знатным особам , извлекая немалую выгоду .Слайд 11 К.В. Шееле
(1742–1786)
Вскоре Ю. Ган и К.В. Шееле
доказали, что
в костях содержится много фосфора.
Антуан Лоран
Лавуазье
В
начале 70-х гг. XVIII в. великий французский ученый А. Лавуазье, сжигая фосфор в замкнутом объеме воздуха, доказал, что фосфор – самостоятельный химический элемент. Бриджмен
В 1847 г. немецкий химик Шретер получил красный фосфор. В 1934 г. американский ученый Бриджмен выделил черный фосфор. Впоследствии были выделены фиолетовый и коричневый фосфор.
Слайд 124)ПОЛУЧЕНИЕ ФОСФОРА;
Свободный фосфор получают в электрических печах без доступа воздуха
из фосфата кальция ,смешивая его с песком и углем:
Ca3(PO4)2
+ C + SiO2 → CaSiO3 + P + COРасставьте коэффициенты методом электронного баланса.
Слайд 135)ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА
А) Взаимодействие с кислородом:
Р + О2 →
Б) Взаимодействие
с бертолетовой солью:
Р + KClO3 → P2O5 + KCl
В) Взаимодействие
с активными металлами:Mg + P →
Допишите уравнения реакций. Какую роль выполняет фосфор в этих реакциях? Составьте электронный баланс к данным реакциям.
Слайд 146)НАХОЖДЕНИЕ В ПРИРОДЕ
Фосфор встречается в природе только в связанном состоянии.
Массовая доля фосфора в земной коре – около 0,12%.
Важнейшие минералы:
Сa3(PO4)2
– фосфорит;3Сa3(PO4)2∙Ca(OH)2 – гидроксиапатит;
3Сa3(PO4)2∙CaF2 – фторапатит.
По содержанию в организме человека фосфор относится к макроэлементам (w(Р) = 0,95%).
Фосфор входит в состав костной, нервной
и мозговой тканей, крови, молока.
Фосфором богаты яйца, мясо, молоко, хлеб.
Слайд 157)ПРИМЕНЕНИЕ ФОСФОРА
Более половины объема мирового производства фосфора перерабатывается
в соединения,
используемые
в синтетических моющих средствах.
Соединения фосфора используют для получения антикоррозионных
добавок
к маслам и горючему для автомобилей.Сульфиды фосфора стали необходимы в сражении с ржавчиной в металлургии.
Фосфор используется при производстве спичек.
Из фосфора получают фосфорную кислоту, которая идет на производство удобрений .
Слайд 16 Я светоносный элемент.
Я спичку вам зажгу в момент.
Сожгут меня –
и под водой
Я сразу стану кислотой.
Запишите уравнения реакций, о ко-
торых
идет речь в этом стихотворе-нии.