Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Обратимость химических реакций. Химическое равновесие
Содержание
- 1. Обратимость химических реакций. Химическое равновесие
- 2. Какие из химических реакций являются обратимыми?1. NaOH
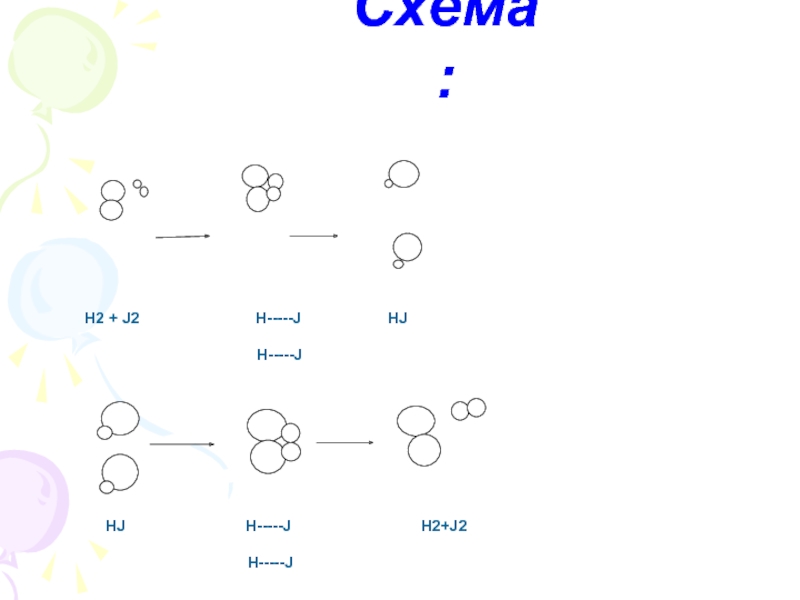
- 3. Схема:
- 4. Слайд 4
- 5. Факторы, влияющие на смещение химического равновесия.
- 6. ➔➔Влияние изменения температуры 2 пробирки крахмального клейстера
- 7. Влияние изменения концентрации+ 2-3 капли FeCl3+ 1-2
- 8. Влияние изменения давления 2NO2 ⬄ N2O4 +
- 9. Практическое значение.Производство NH3
- 10. Производство H2SO4
- 11. Производство HNO3
- 12. 1.Смещение химического равновесия
- 13. Слайд 13
- 14. Скачать презентанцию
Какие из химических реакций являются обратимыми?1. NaOH + HCl ➔ NaCl + H2O2. N2 + 3H2 ➔ 2NH33. AgNO3 + NaCl ➔ AgCl + NaNO34. SO3 + H2O ➔ H2SO45. CH4
Слайды и текст этой презентации
Слайд 2Какие из химических реакций являются обратимыми?
1. NaOH + HCl ➔
NaCl + H2O
2. N2 + 3H2 ➔ 2NH3
3. AgNO3 +
NaCl ➔ AgCl + NaNO34. SO3 + H2O ➔ H2SO4
5. CH4 + 2O2 ➔ CO2 + 2H2O
6. 2SO2 + O2 ➔ 2SO3
7. HCOOH + CH3OH ➔ HCOOCH3 + H2O
Слайд 6➔
➔
Влияние изменения температуры
2 пробирки крахмального клейстера
Добавляем 2 капли J2
•При
повышенной t, окраска исчезает, равновесии смещается в сторону обратной реакции.
• При пониженной t, окраска появляется, равновесие смещается в сторону прямой реакции.
Слайд 7Влияние изменения концентрации
+ 2-3 капли FeCl3
+ 1-2 капли KNCS
+
1-2 капли KCl
При увеличении концентрации реогир. веществ или уменьшение концентрации
продукта реакции химическое равновесие смещается в сторону продуктов реакции При увеличении концентрации продуктов реакции или уменьшение концентрации реагирующих веществ химическое равновесие смещается в сторону исходных веществ.
Слайд 8Влияние изменения давления
2NO2 ⬄ N2O4 + Q
При расширении цвет газа
стал темно-бурым, а равновесие сместилось
в сторону обратной реакции.При сжатии цвет газа стал бледно-желтым, а равновесие сместилось в сторону прямой реакции.
При увеличении давления равновесие смещается в сторону меньшего объема
Слайд 12 1.Смещение химического равновесия обеспечивает высокий выход
желаемого продукта.
2. Открывает путь к управлению
химическими реакциями.
Теги