Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь (8 класс)
Содержание
- 1. Химическая связь (8 класс)
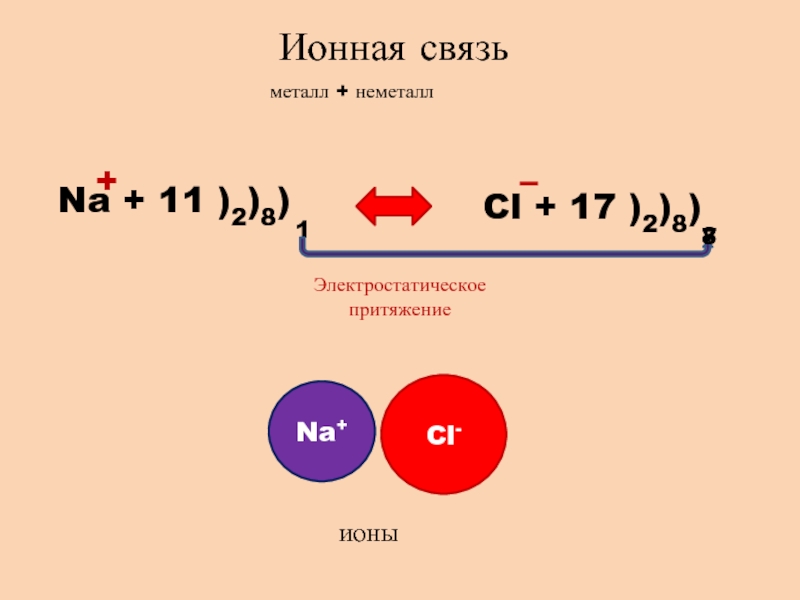
- 2. Ионная связьметалл + неметаллNa + 11 )2)8)1Cl + 17 )2)8)78+– Электростатическое притяжениеNa+Cl-ионы
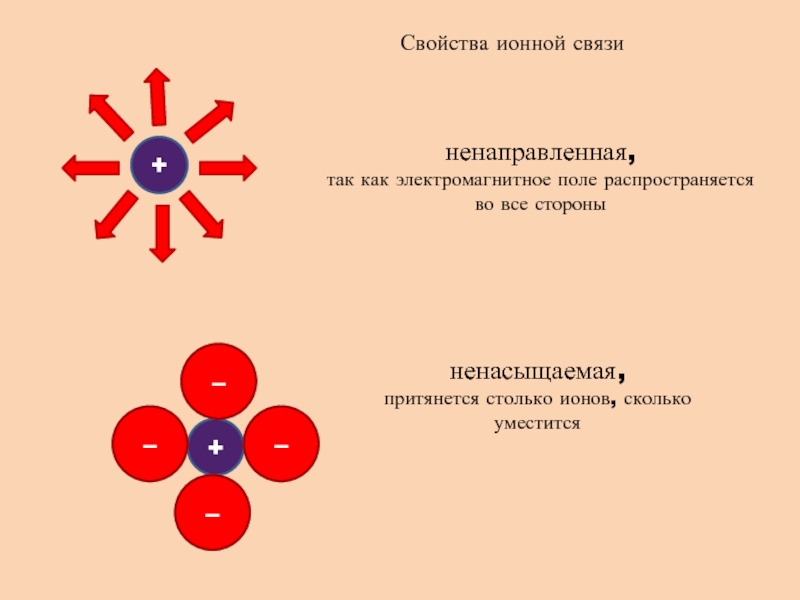
- 3. Свойства ионной связиненаправленная, так как электромагнитное поле
- 4. Поэтому все вещества с ионной связью имеют немолекулярное строениеКристаллическая решетка
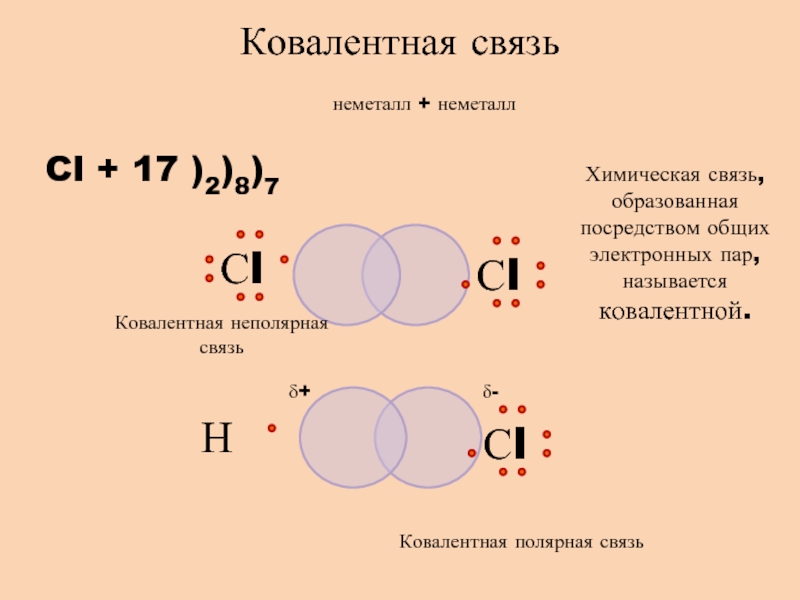
- 5. неметалл + неметаллCl + 17 )2)8)7Ковалентная связьХимическая
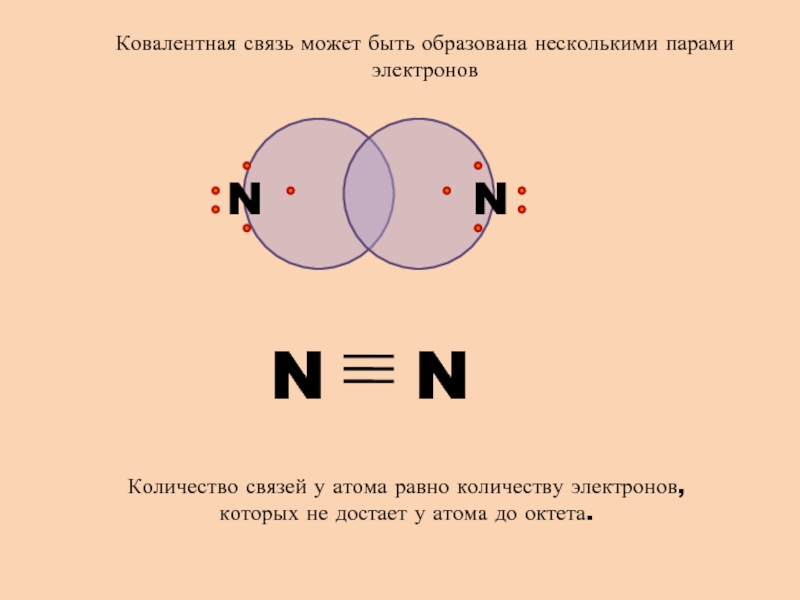
- 6. N NКовалентная связь может быть образована несколькими
- 7. Свойства ковалентной связинаправленная, атомы должны расположиться определенным образом.насыщаемая, связывает два атома, «третий – лишний»
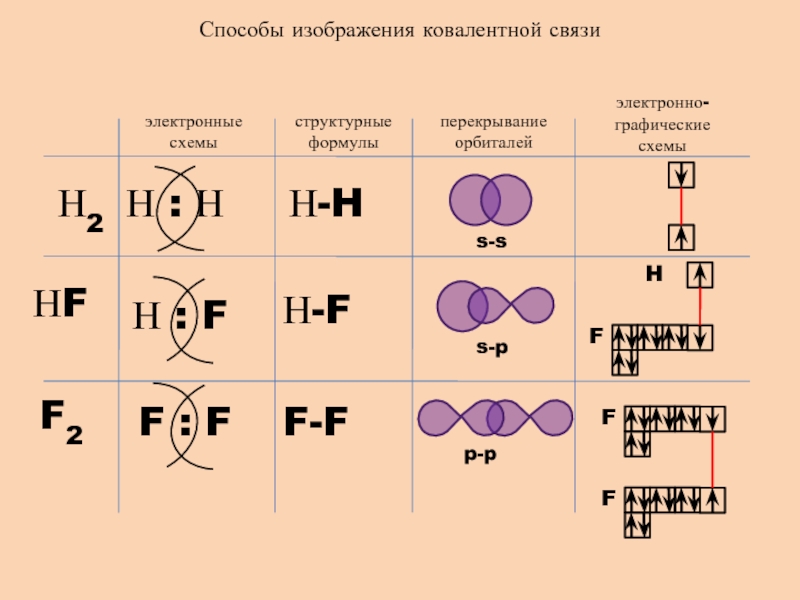
- 8. Способы изображения ковалентной связиэлектронные схемыструктурные формулыперекрывание орбиталейэлектронно-графические схемыН2НFF2Н-FН-HF-Fs-ss-pp-pH
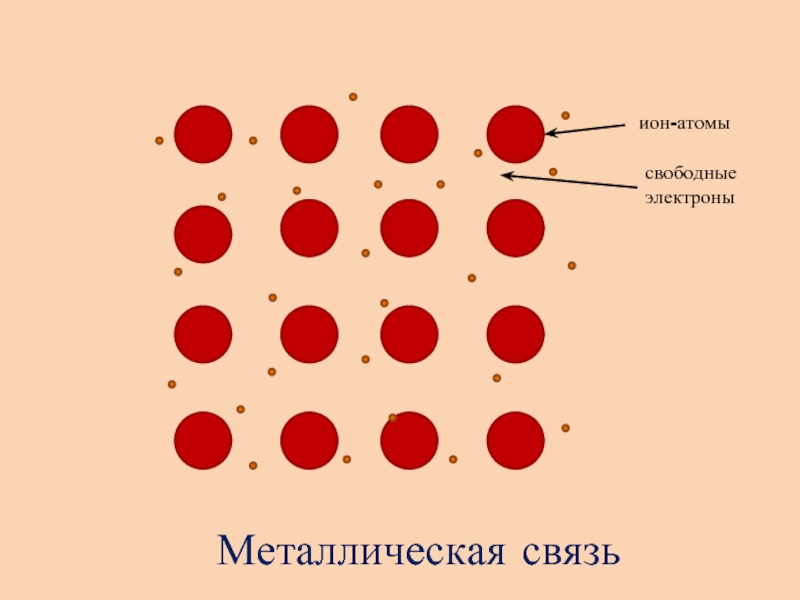
- 9. ++++++++++++++++ион-атомысвободные электроныМеталлическая связь
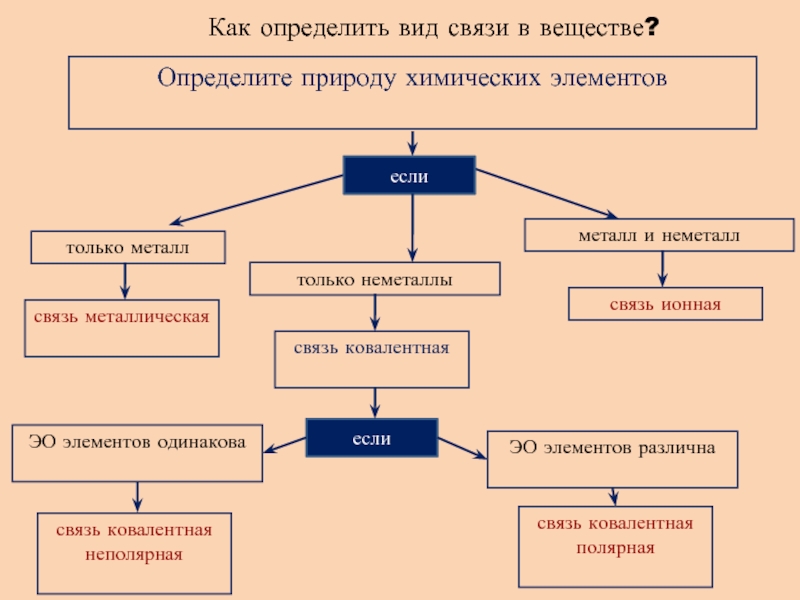
- 10. Как определить вид связи в веществе?Определите природу
- 11. Определите вид связи в следующих веществах: Н2,
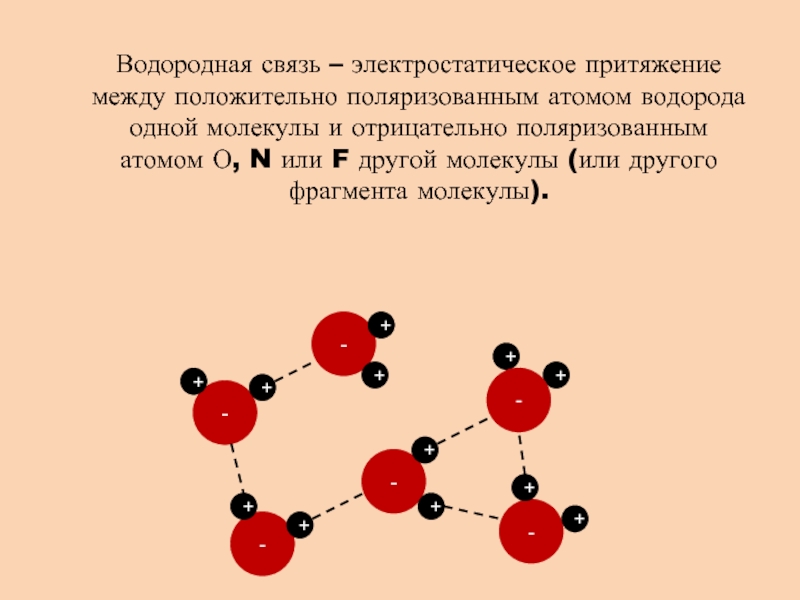
- 12. Водородная связь – электростатическое притяжение между положительно
- 13. Скачать презентанцию
Ионная связьметалл + неметаллNa + 11 )2)8)1Cl + 17 )2)8)78+– Электростатическое притяжениеNa+Cl-ионы
Слайды и текст этой презентации
Слайд 3Свойства ионной связи
ненаправленная,
так как электромагнитное поле распространяется во все
стороны
ненасыщаемая,
притянется столько ионов, сколько уместится
Слайд 5неметалл + неметалл
Cl + 17 )2)8)7
Ковалентная связь
Химическая связь, образованная посредством
общих электронных пар, называется ковалентной.
δ+
δ-
Ковалентная полярная связь
Ковалентная неполярная связь
Слайд 6N
N
Ковалентная связь может быть образована несколькими парами электронов
Количество связей
у атома равно количеству электронов, которых не достает у атома
до октета.Слайд 7Свойства ковалентной связи
направленная,
атомы должны расположиться определенным образом.
насыщаемая,
связывает два
атома,
«третий – лишний»
Слайд 8Способы изображения ковалентной связи
электронные схемы
структурные формулы
перекрывание орбиталей
электронно-графические схемы
Н2
НF
F2
Н-F
Н-H
F-F
s-s
s-p
p-p
H
Слайд 10Как определить вид связи в веществе?
Определите природу химических элементов
если
только металл
только
неметаллы
металл и неметалл
если
связь металлическая
связь ковалентная
связь ионная
связь ковалентная полярная
связь ковалентная неполярная
ЭО
элементов одинаковаЭО элементов различна
Слайд 11Определите вид связи в следующих веществах:
Н2, Na, NaF, H2S,
NH3, O2, Zn, CaS, Mg3N2, CH4, Al, F2.
Слайд 12Водородная связь – электростатическое притяжение между положительно поляризованным атомом водорода
одной молекулы и отрицательно поляризованным атомом О, N или F
другой молекулы (или другого фрагмента молекулы).
Теги