1. Элемент
№ 8 2. Oxygenium - Кислород
3. Джозеф Пристли
4. Карл Вильгельм Шееле
5. Антуан Лоран Лавуазье
6. Корнелиус Дреббел
7. Распространение элементов в земной коре
8. Нахождение кислорода в природе
9. Состав воздуха
10. Выдыхаемый воздух
11. Городской воздух
12. Общая характеристика элемента
13. Аллотропия кислорода
14. Озон
15. Способы собирания газа, обнаружение
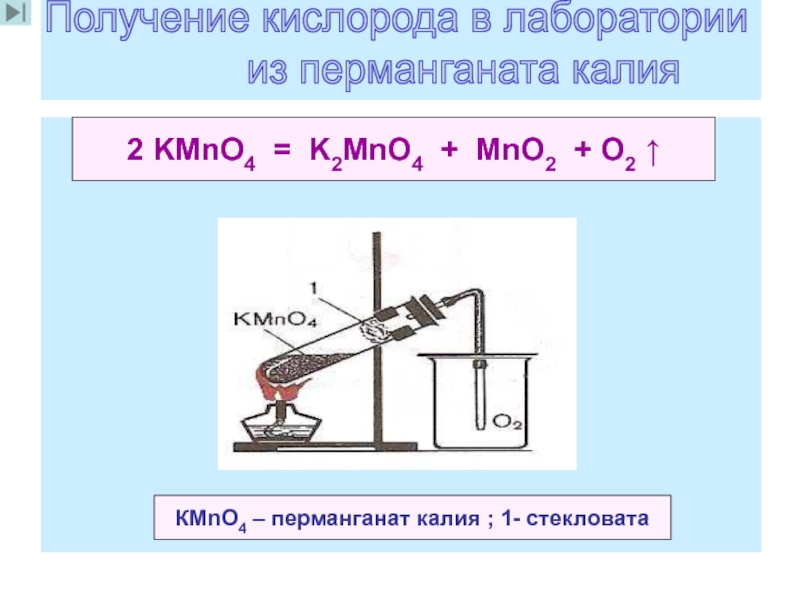
16. Получение кислорода в лаборатории из перманганата калия
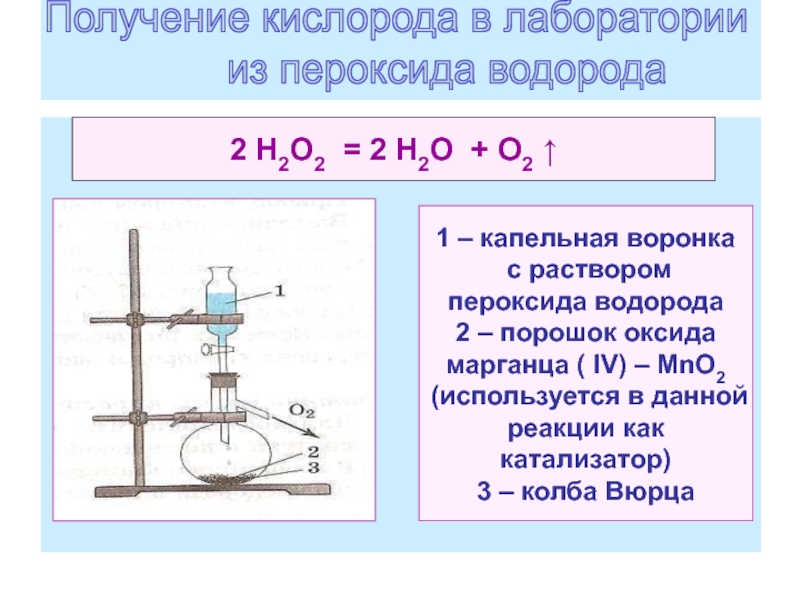
17. Получение кислорода в лаборатории из пероксида водорода
(продолжение следует – см. следующий слайд)
СОДЕРЖАНИЕ