Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Предмет органической химии. Классификация органических веществ
Содержание
- 1. Предмет органической химии. Классификация органических веществ
- 2. План1. Определение предмета орг. химии.2. Признаки органических
- 3. 1. Органическая химия – наука о соединениях
- 4. 3. В учебнике «Основы химии» Д.И.Менделеев писал:
- 5. В органических веществах существуют, в основном, ковалентные
- 6. б) Если наибольшая электронная плотностьнаходится под углом
- 7. В образовании сигма (σ)-связи участвуют гибридизованные электронные
- 8. Слайд 8
- 9. Органические соединения делятся на три большие группы:1.
- 10. Кислородсодержащие органические вещества делятся на спирты, простые
- 11. Ковалентные связи, образующие органичес-кие вещества, могут разрушаться
- 12. УРОК № 2 Теория
- 13. План урока1.Письменный опрос:а)В чем заключается виталистическая теория
- 14. 2.Основные положения ТХС.3.Понятия валентности, гомологии, изомерии.4.Структурные формулы
- 15. Слайд 15
- 16. Слайд 16
- 17. Атомы, соединенные в молекулу, взаимно влияют
- 18. 1.Валентность – это свойство атомов ХЭ образовывать
- 19. Гомологический ряд метана:СН4,
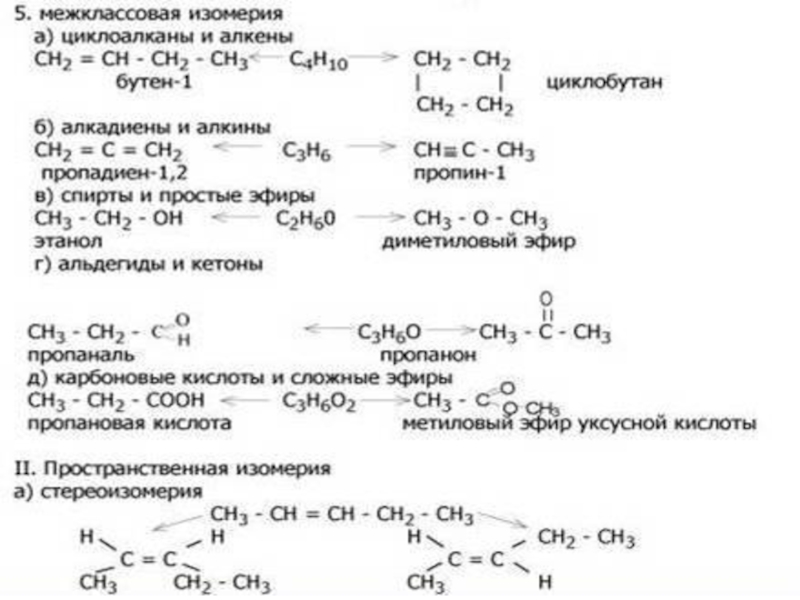
- 20. 3.Изомеры – это в – ва, которые имеютодинаковую молекулярную формулу(качественный и количественный состав),но разное строение.
- 21. Слайд 21
- 22. Слайд 22
- 23. Урок №3
- 24. Слайд 24
- 25. Предельные УВ (алканы, парафины) - это
- 26. В молекулах алканов существуетмалополярная (s
- 27. Первое валентное состояние углерода.
- 28. В алканах атомы углерода находятся вsp3-
- 29. В ряду алканов существует изомерия поразветвлению
- 30. Физические свойства алкановТаблица с. 26, учебник.
- 31. Вывод: Изменение физических свойств парафиновподтверждают
- 32. Ресурсы Габриелян О.С. Химия. 10 класс. Базовый
- 33. Скачать презентанцию
План1. Определение предмета орг. химии.2. Признаки органических веществ.3. Особенности углерода.4. Виды ковалентной связи, тип гибридизации электронных облаков. 5. Классификация органических веществ.6. Круговорот углерода в природе.
Слайды и текст этой презентации
Слайд 1Урок №1
Предмет органической химии. Классификация органических веществ
Презентация к уроку химии
для 10 класса
СОШ № 5 г. СветлогоСлайд 2План
1. Определение предмета орг. химии.
2. Признаки органических веществ.
3. Особенности углерода.
4.
Виды ковалентной связи, тип гибридизации электронных облаков.
5. Классификация органических
веществ.6. Круговорот углерода в природе.
Слайд 31. Органическая химия – наука о соединениях углерода, их свойствах,
строении и превращениях.
2. Признаки органических веществ:
а) горение с образованием углекислого
газа и воды;б) разложение при нагревания с выделением углерода (сажа);
в) почти все имеют молекулярную кристаллическую решетку.
Слайд 43. В учебнике «Основы химии» Д.И.Менделеев писал: «Способность атомов углерода
соединяться между собой и давать сложные частицы проявляется во всех
углеродистых соединениях. Ни в одном из элементов способности к усложнению не развито в такой степени, как в углероде. Ни одна пара элементов не дает столь много соединений, как углерод с водородом.»Ученые А. Кекуле и А. Купер установили, что углерод всегда четырехвалентен и способен образовывать углерод - углеродные цепи.
Кроме этого, строение атомов углерода позволяет образовывать простые и кратные связи.
Слайд 5В органических веществах существуют, в основном, ковалентные химические связи:
а) А. + .А = А:А б) А:
+ :А = А: :АКовалентные связи делятся на сигма(σ) -связь и пи(π)-связь.
а) Если наибольшая электрнная плотность находится на прямой между ядрами атомов – это сигма(σ)-связь.
Слайд 6б) Если наибольшая электронная плотность
находится под углом к ядрам атомов,
такая
ковалентная связь называется пи(π) - связью.
ПРИМЕЧАНИЕ:
При наличии между двумя
атомами ХЭ
2-х или 3-х химических связей одна из них будет сигма-связь, а остальные - пи-связи.Слайд 7В образовании сигма (σ)-связи участвуют гибридизованные электронные облака.
Гибридизация – это выравнивание электронных облаков по форме, величине и
энергии.Существует три типа гибридизации:
а) sp3 – гибридизация;
б) sp2 – гибридизация;
в) sp – гибридизация.
В органических веществах гибридизации подвергаются электронные облака атомов углерода. От типа гибридизации зависит строение органических веществ, а, следовательно, свойства.
Слайд 9Органические соединения делятся на три большие группы:
1. Углеводороды.
2. Кислородсодержащие.
3. Азотсодержащие.
Классы
углеводородов отличаются типом гибридизации и числом пи - связей.
Слайд 10Кислородсодержащие органические вещества делятся на спирты, простые эфиры, альдегиды, карбоновые
кислоты, сложные эфиры, углеводы и т. д..
Азотсодержащие:
амины, аминокислоты, белки,
нуклеиновые кислоты.6 CO2 + 6 H2 O = C6 H12 О6 + 6 О2
Фотосинтез
Слайд 11Ковалентные связи, образующие органичес-
кие вещества, могут разрушаться под дейст-
вием природных
факторов, поэтому углерод
совершает непрерывный круговорот в при-
роде.
Д/З: конспект, №1, з.6
(5), вопросы 2, 3, 4.Слайд 13План урока
1.Письменный опрос:
а)В чем заключается виталистическая
теория Берцелиуса? Крах вит.
теории.
б)Перечислить особенности орг. соед-й.
в)Строение атома углерода. Определение
понятия гибридизации.
г) Типы ковалентной
связи. Изобразитьсхемы образования.
д)Виды гибридизации.
Слайд 142.Основные положения ТХС.
3.Понятия валентности, гомологии,
изомерии.
4.Структурные формулы орг. соединений.
Д/З №2,
составить формулы двух
гомологов и двух изомеров к С6Н14(гексан)
Подготовиться к зачету
«ТХС, гомологи,изомеры».
Слайд 17 Атомы, соединенные в молекулу, взаимно влияют друг на друга.
Наибольшее
влияние оказывают атомы,
соединенные непосредственно.
Структурные формулы показывают
порядок соединения атомов в молекуле.
Следовательно,
для каждого веществасуществует только одна формула
строения.
Слайд 181.Валентность – это свойство атомов ХЭ образовывать определенное число химических
связей.
2.Вещества, которые имеют одинаковый
качественный состав и сходное строение,
но отличаются друг
от друга на группуатомов -СН2 - (одну или несколько),
называются гомологами.
Слайд 19Гомологический ряд метана:
СН4, С2Н6,
С3Н8, С4Н8
Метан
Этан Пропан БутанГомологический ряд этилена:
С2Н4, С3Н6 С4Н8 С5Н10
Этен Пропен Бутен Пентен
Гомологический ряд ацетилена:
С2Н2, С3Н4 С4Н6 С5Н8
Этин Пропин Бутин Пентин
Слайд 203.Изомеры – это в – ва, которые имеют
одинаковую молекулярную формулу
(качественный
и количественный состав),
но разное строение.
Слайд 24
План
1.Определение алканов.
2.Строение молекулы:
а)первое валентное состояние углерода
б)пространственное
строение молекулв)изомерия и номенклатура алканов
3.Физические свойства.
4.Зачет по теме«ТХС,гомологи, изомеры»
Слайд 25 Предельные УВ (алканы, парафины) -
это соединения, в которых
химические
связи углерода до предела насыщены
атомами водорода.
С5Н12, С6Н14 С7Н16 С8Н18
Пентан Гексан Гептан Октан
С9Н20 – нонан С10Н22 - декан
СnH2n+2 – общая формула парафинов.
Гомологический ряд метана:
СН4, С2Н6, С3Н8, С4Н8
Метан Этан Пропан Бутан
Слайд 26 В молекулах алканов существует
малополярная (s – p) и
неполярная (р – р)
сигма – связь. Эта связь очень прочная
ималополяризуемая, поэтому данные УВ
являются устойчивыми, на них не
действуют при обычных условиях р – ры
кислот, щелочей и окислители.
(Pаrаfinоs – пассивный (греч.)).
Слайд 28 В алканах атомы углерода находятся в
sp3- гибридизации. Это первое
валентное
состояние атомов углерода.
Гибридизованные электронные облака
взаимно отталкиваются и образуют
угол109о 28/ . Длина С – С связи составляет
0,154 нм. Вследствие этого молекулы
приобретают тетраэдрическое строение и
в пространстве имеют вид зигзага (если
С > 3).
Слайд 29 В ряду алканов существует изомерия по
разветвлению углеродного скелета. В
р – х
изомеризации УВ нормального строения
превращаются в разветвленные.
CH3CH3- CH2- CH2-CH2-CH3 -> H3C - C - CH3
н - пентан СН3
2,2 – диметилпропан
Катализатор реакции – Al Cl3, to .
**Составьте формулу 2,3 – диметилбутана.
Слайд 31 Вывод:
Изменение физических свойств парафинов
подтверждают один из законов
диалектики –
переход количества в качество.
4. Зачетная работа:
с.32, упр.7, 8.1в.- б, определение валентности.
2в.- в, 1-е положение ТХС.
3в.- г, 2-е положение ТХС.
4в.- упр.8 , 3-е положение ТХС.
Д/з: №3, в упр.7 назвать в – ва, з.12, в-сы 9,10.
Слайд 32Ресурсы
Габриелян О.С. Химия. 10 класс. Базовый уровень: учебник, базовый
уровень – М.: Дрофа, 2007.
Химия. 10 класс. Базовый уровень: учебник
/ Под ред. В.И. Тренина. – М.: Дрофа, 2002.Смолина Т.А. Практические работы по органической химии: Малый практикум. – М.: Просвещение, 1986.
CD – Органическая химия. 10-11классы. Лаборатория систем мультимедиа, МарГТУ, 2003.
CD – Химия (8-11 класс). Виртуальная лаборатория. Лаборатория систем мультимедиа, МарГТУ, 2004.
CD – Химия. Интерактивный тренинг – подготовка к ЕГЭ. Новая школа, 2007.
CD – Химия. Базовый курс. Лаборатория систем мультимедиа, МарГТУ, 2003.