Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация к уроку по химии "Электролитическая диссоциация"
Содержание
- 1. Презентация к уроку по химии "Электролитическая диссоциация"
- 2. Это важно вспомнитьЧто такое растворение?Физико-химический процессЧто такое
- 3. Это важно вспомнить История развития теории
- 4. Подумай Вы торопись в школу, но еще
- 5. Слайд 5
- 6. Электролитическая диссоциация
- 7. Сформировать понятия об электролитах и неэлектролитах.Рассмотреть механизм
- 8. Испытание веществ на электрическую проводимость Электропроводность веществ
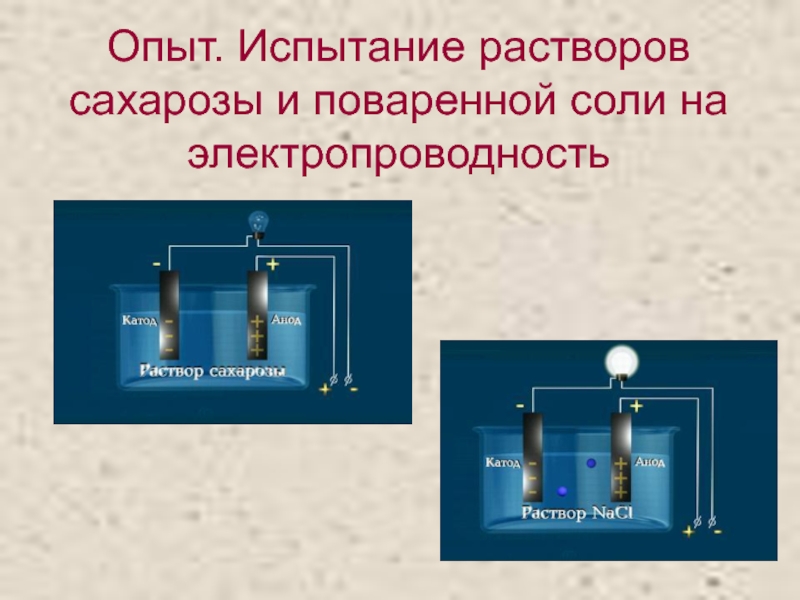
- 9. Опыт. Испытание растворов сахарозы и поваренной соли на электропроводность
- 10. Слайд 10
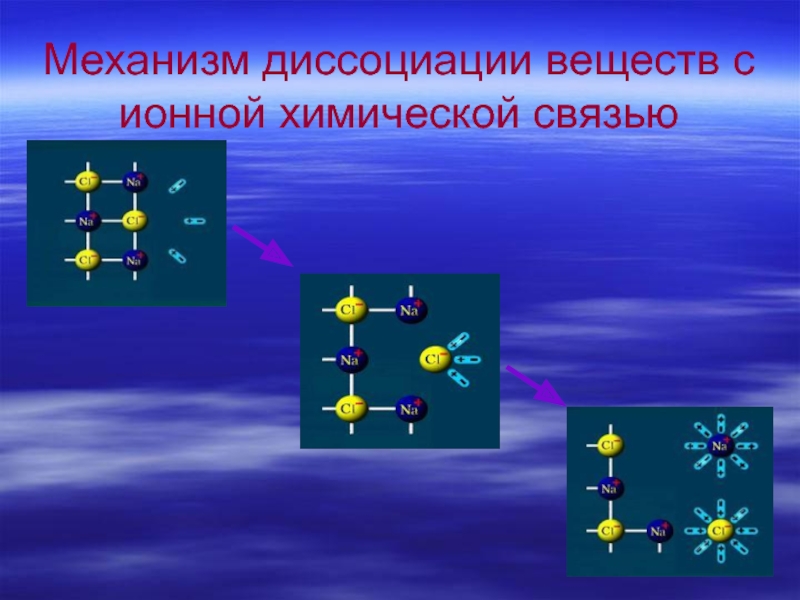
- 11. Механизм диссоциации веществ с ионной химической связью
- 12. Механизм диссоциации веществ с ковалентной химической связью
- 13. Распад веществ на ионы при растворении в воде- электролитическая диссоциация
- 14. Уравнения диссоциации веществ
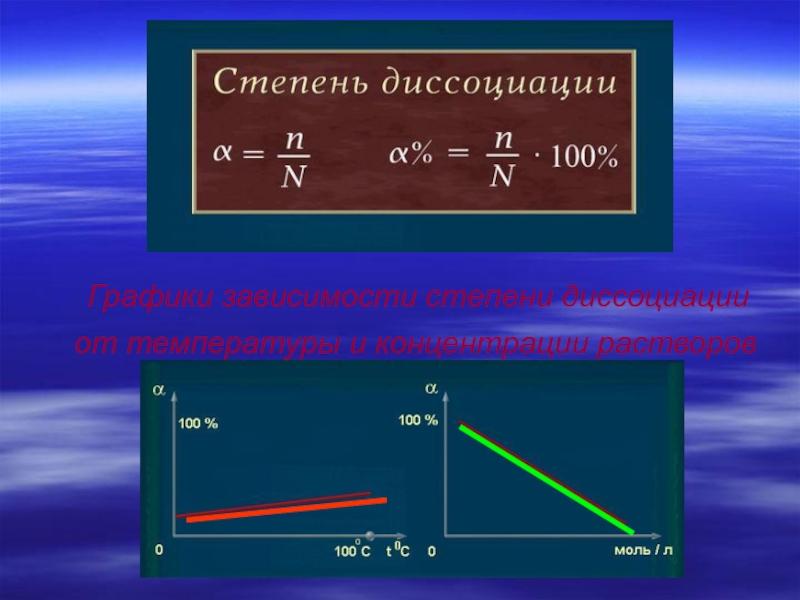
- 15. от температуры и концентрации растворов от температуры и концентрации растворовГрафики зависимости степени диссоциации
- 16. Зависимость электропроводности растворов от концентрации
- 17. Изменение диссоциации электролитов при различных температурах Электропроводность
- 18. Слайд 18
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Диссоциация солей
- 23. Диссоциация оснований
- 24. Диссоциация кислот
- 25. Диссоциация кислых и основных солей
- 26. Проверь себяНа рисунке изображены пересекающиеся
- 27. Проверь себя2. На рисунке изображены пересекающиеся
- 28. Проверь себяНа рисунке изображены пересекающиеся
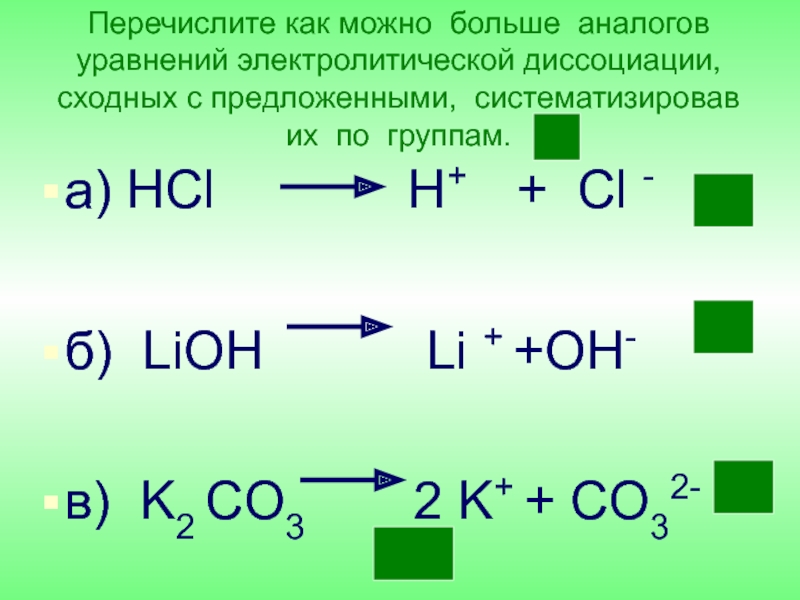
- 29. Перечислите как можно больше аналогов уравнений электролитической
- 30. Слайд 30
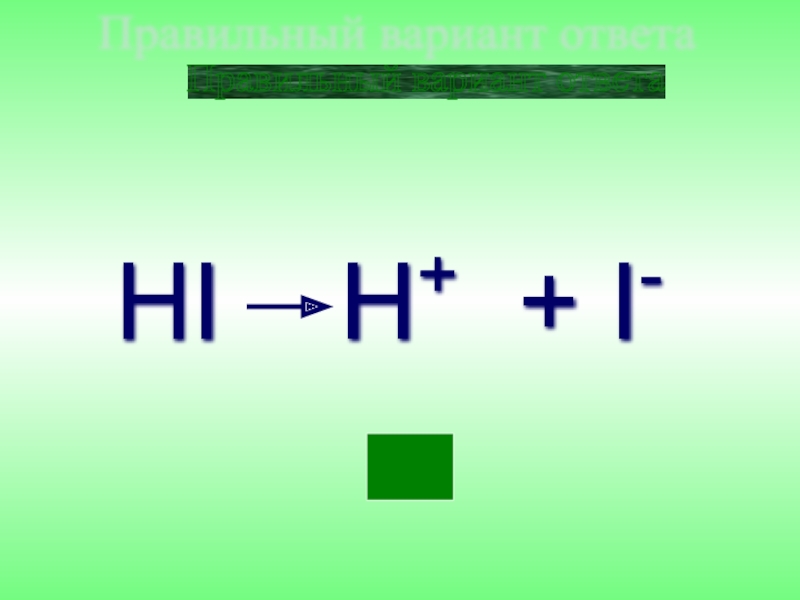
- 31. HI H+ + I- Правильный вариант ответа
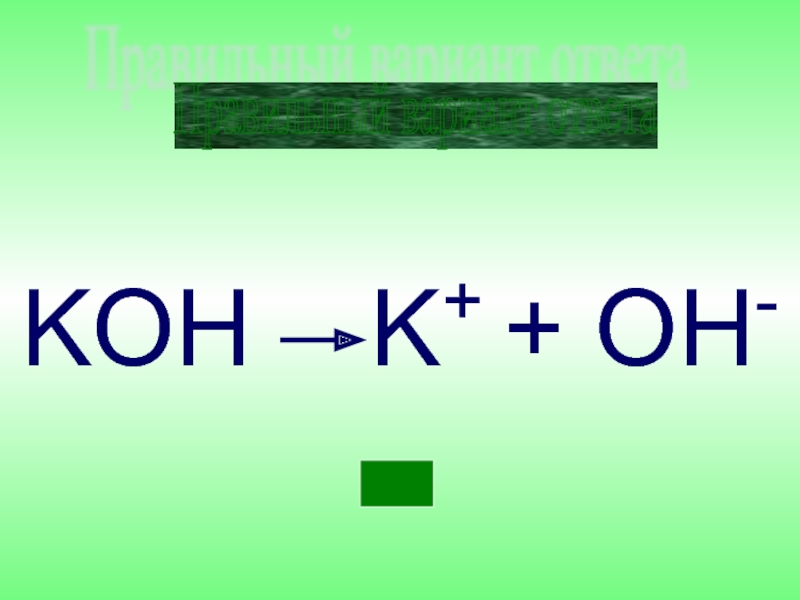
- 32. KOH K+ + ОH- Правильный вариант ответа
- 33. Na2 SO4 2Na++SO42- Правильный вариант ответа
- 34. Электролиты- это…Неэлектролиты- это…Электролитическая диссоциация - это…Катионы –
- 35. РефлексияЧто я узнал на уроке?Выполнил ли поставленные
- 36. Домашнее заданиеП. 35, упражнение 1-4, 5-6(индивидуально)
- 37. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Это важно вспомнить
Что такое растворение?
Физико-химический процесс
Что такое растворы?
Однородная гомогенная система
Слайд 3Это важно вспомнить
История развития теории растворов
1.Физическая теория
Растворение- результат
диффузии .Растворы –это однородные смеси.
Вант- Гофф, Аррениус, Оствальд
2.Химическая теория
Растворение-
это химическое взаимодействие растворенного вещества с водой, называемое гидратацией. Растворы -это химические соединения, гидраты.Менделеев, Каблуков, Кистяковский.
3.Современная теория растворов?
Слайд 4Подумай
Вы торопись в школу, но еще не пили чай.
Перед вами дилемма: или пить горячий чай, но сладкий, или
холодный, но не сладкий? Где быстрее растворяются кусочки сахара: в горячем чае или холодном? От чего зависит растворение твердых веществ?Слайд 7Сформировать понятия об электролитах и неэлектролитах.
Рассмотреть механизм диссоциации веществ с
ионной и ковалентной связью.
Ввести понятие ,,степень электролитической диссоциации,, и
рассмотреть классификацию электролитов.Цели и задачи
Слайд 8Испытание веществ на электрическую проводимость
Электропроводность веществ можно испытать с помощью
прибора. Между электродами прибора – напряжение 36 вольт. Когда электроды
помещают в вещество, становится ясно, проводит ли это вещество ток. Если вещество проводит электрический ток, цепь замыкается, и лампочка загорается. Если вещество неэлектропроводно, цепь остается разомкнутой, и лампочка не горит.Испытание твердых веществ. Насыпаем сахар в чашку Петри и подносим к электродам. Лампочка не горит, значит сахар (органическое вещество) не проводит электрический ток. Щелочь ‑ твердый гидроксид натрия (NaOH), тоже не проводит ток. Возьмем поваренную соль - кристаллический хлорид натрия (NaCl). Лампочка не горит. Все испытанные твердые вещества не проводят электрический ток.
Электропроводны ли растворы этих веществ?
Испытание жидкостей. Раствор гидроксида натрия электропроводен: лампочка загорается. Лампочка горит и при испытании раствора поваренной соли. Электропроводен также раствор соляной кислоты (HCl). Все испытанные растворы оказались электролитами. ( Жидкости, проводящие электрический ток, называются электролитами. Электропроводность электролитов обеспечивают ионы .) Проверим, является ли электролитом дистиллированная вода. Лампочка не горит. Ионов в дистиллированной воде совсем немного, поэтому электропроводность воды низкая. Дистиллированная вода – очень слабый электролит. В растворе сахара нет подвижных заряженных частиц. Ток в цепи не идет. Раствор сахара – не электролит. Спирт, как и раствор сахара, не является электролитом.
Оборудование: установка для испытаний веществ на электропроводность (выпрямитель, электроды, лампа накаливания), чашки Петри, стаканы.
Техника безопасности.
Следует соблюдать правила работы с кислотами и щелочами, правила работы с электроприборами. Опыт проводить с напряжением не более 42 В.
Посмотреть опыт
http://files.school-collection.edu.ru/dlrstore/f5aeec90-899e-4ce-df97-5627a9393b16/index.htm
Слайд 15
от температуры и концентрации растворов
от температуры и концентрации
растворов
Графики зависимости степени диссоциации
Слайд 16 Зависимость электропроводности растворов от концентрации
Зависимость электропроводности растворов от
концентрации
Электропроводность веществ можно испытать с помощью прибора. Между электродами прибора
– напряжение 36 вольт. Когда электроды помещают в вещество, становится ясно, проводит ли это вещество ток. Если вещество проводит электрический ток, цепь замыкается, и лампочка загорается. Если вещество неэлектропроводно, цепь остается разомкнутой, и лампочка не горит. Чем ярче горит лампочка, тем выше электропроводность вещества. Проверим, проводит ли электрический ток концентрированная уксусная кислота. Лампочка не загорается, электропроводность раствора ‑ низкая. Уксусная кислота ‑ слабый электролит. Разбавляем кислоту водой – спираль лампочки начинает накаляться. Разбавление приводит к образованию большего числа токопроводящих частиц ‑ ионов и увеличению проводимости раствора.СH3COOН <=> СH3COO- + Н+
Оборудование: Установка для испытаний веществ на электропроводность (выпрямитель, электроды, лампа накаливания), химические стакан.
Посмотреть опыт
http://files.school-collection.edu.ru/dlrstore/86b30026-9748-4500-f80a-c28045f5ebe5/index.htm
Слайд 17Изменение диссоциации электролитов при различных температурах
Электропроводность веществ можно испытать с
помощью прибора. Между электродами прибора – напряжение 36 вольт. Когда
электроды помещают в вещество, становится ясно, проводит ли это вещество ток. Если вещество проводит электрический ток, цепь замыкается, и лампочка загорается. Если вещество неэлектропроводно, цепь остается разомкнутой, и лампочка не горит. Чем ярче горит лампочка, тем выше электропроводность вещества. Уксусная кислота – слабый электролит. Это означает, что она лишь частично диссоциирует в растворе и плохо проводит ток. Зависит ли диссоциация, а значит и проводимость электролита от температуры? Раствор при комнатной температуре слабо проводит электрический ток: спираль лампочки не накалена.Горячая уксусная кислота лучше проводит ток – лампочка загорается. Значит, с увеличением температуры в растворе становится больше ионов, диссоциация увеличивается.СН3СООН <=> СН3СОО- + Н+
Оборудование: Установка для испытаний веществ на электропроводность (выпрямитель, электроды, лампа накаливания), химические стаканы, термометр.
Посмотреть опыт
http://files.school-collection.edu.ru/dlrstore/2a995023-1dbe-4d10-8236-a63ac15868a4/index.htm
Слайд 26Проверь себя
На рисунке изображены пересекающиеся понятия , отображенные
с помощью круговых схем . В круг 1 входят простые
ионы ,а в круг 2 -анионы. Подберите формулы ионов для заполнения круговых схем .Круг 1.Простые ионы
Круг 2.Анионы
Nа+
Cа2+
Fe2+
Cl-
Br-
F-
SO42-
CO32-
PO43-
Слайд 27Проверь себя
2. На рисунке изображены пересекающиеся понятия ,
отображенные с помощью круговых схем . В круг 1 входят
сложные ионы ,а круг 2 – анионы. Подберите формулы ионов для заполнения круговых схем .Круг 2.Анионы
Круг 1Сложные ионы
SiO32-
NH4+
Cl-
Br-
SO42-
S2-
Слайд 28Проверь себя
На рисунке изображены пересекающиеся понятия, отображенные с
помощью круговых схем. В круг 1 входят сложные ионы ,
а в круг 2- катионы .Подберите формулы ионов для заполнения круговых схем.Круг 1Сложные ионы
Круг 2.Катионы
NH4+
SO42-
CO32-
K+
Ca2+
Слайд 29Перечислите как можно больше аналогов уравнений электролитической диссоциации, сходных с предложенными,
систематизировав их по группам.
а) HCl
H+ + Cl - б) LiOH Li + +OH-
в) K2 CO3 2 K+ + CO32-
Слайд 30 Можно использовать
следующие признаки для подбора аналогов: 1. класс вещества,
которое диссоциирует; 2. заряд катиона (аниона),который образуется при диссоциации; 3. число катионов (анионов),которые образуются при диссоциации.
Слайд 34Электролиты- это…
Неэлектролиты- это…
Электролитическая диссоциация - это…
Катионы – это…
Анионы- это…
Простые ионы-
это…
Сложные ионы- это ..
Степень диссоциации- это…
Сильные электролиты – это …
Слабые
электролиты – это…Степень диссоциации зависит от…
Закончи предложения