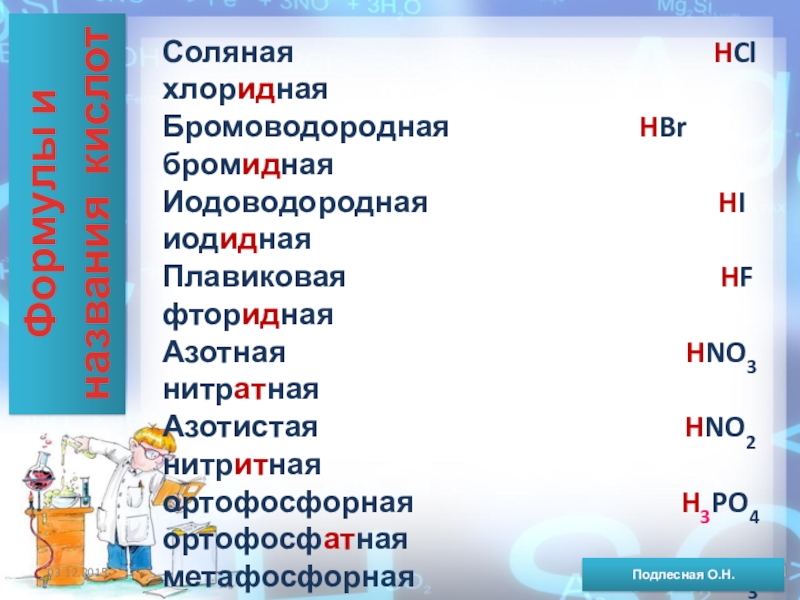
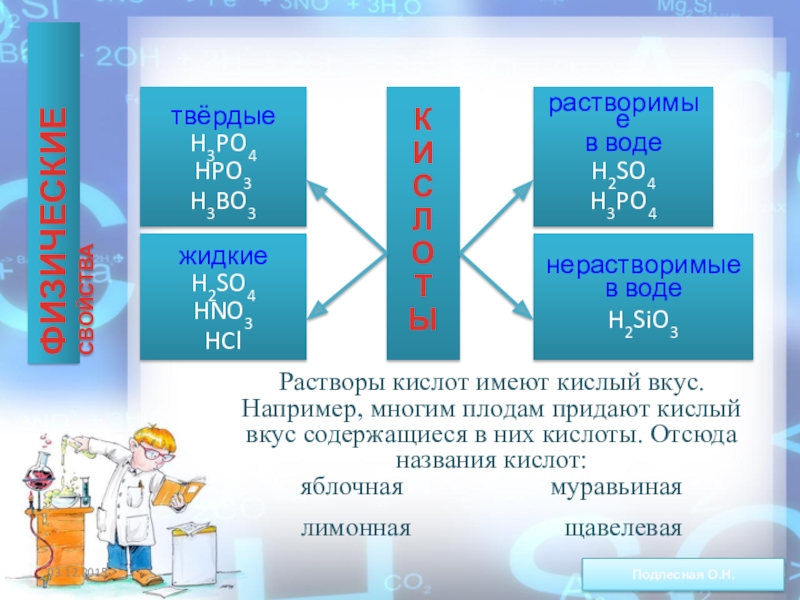
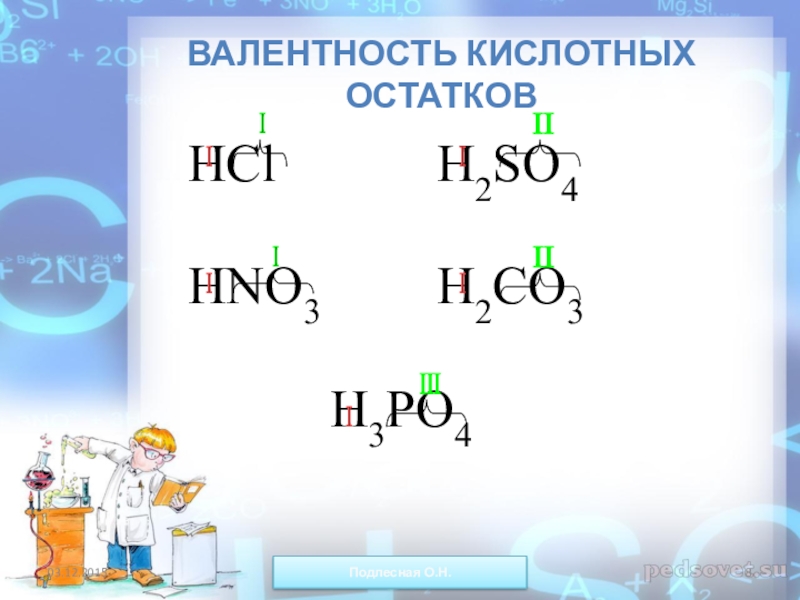
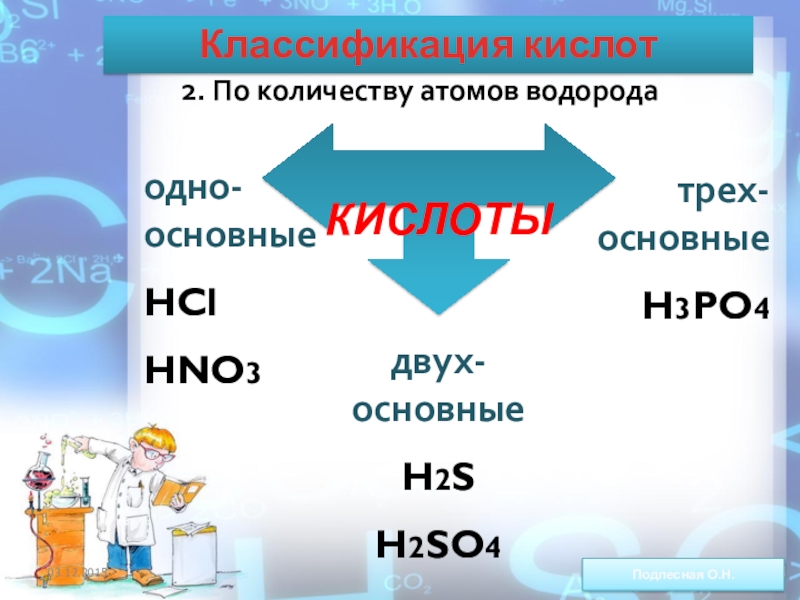
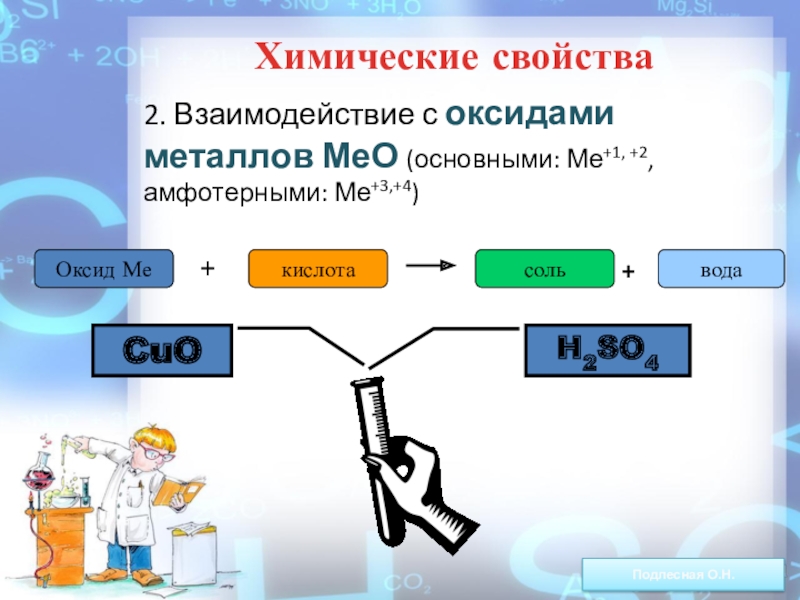
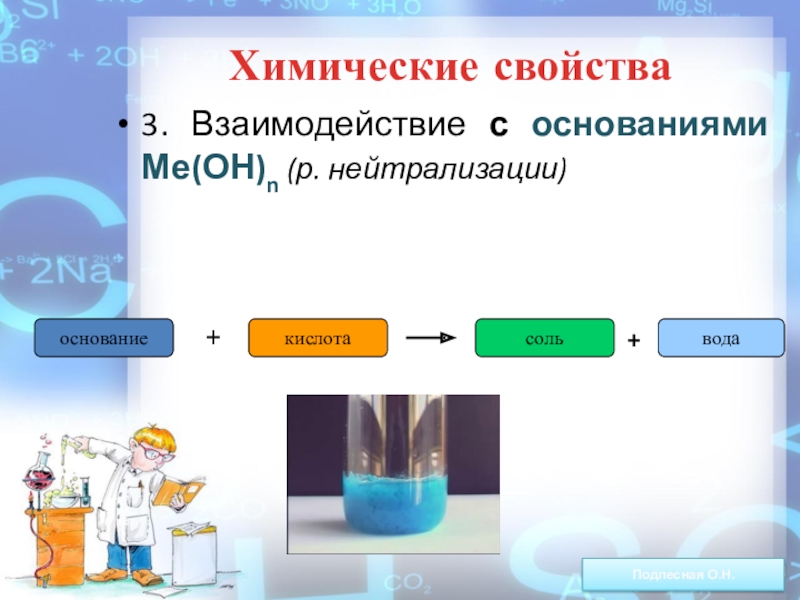
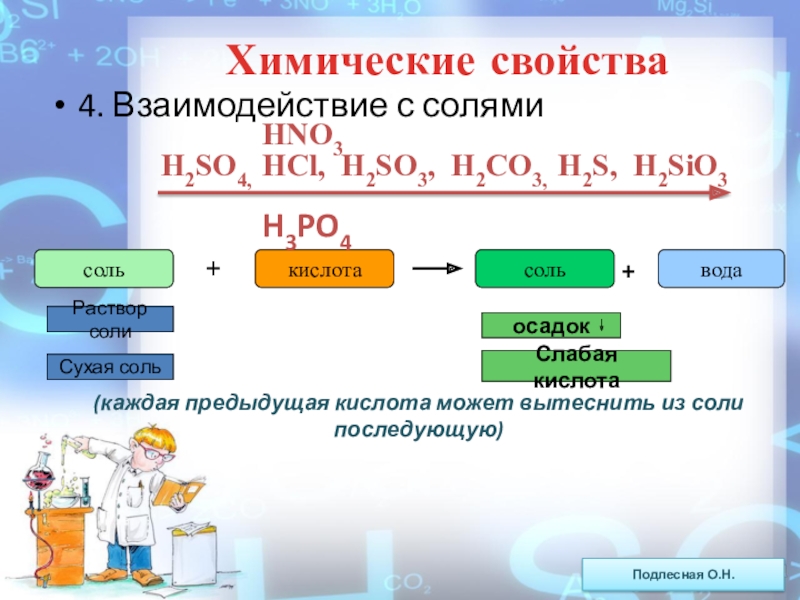
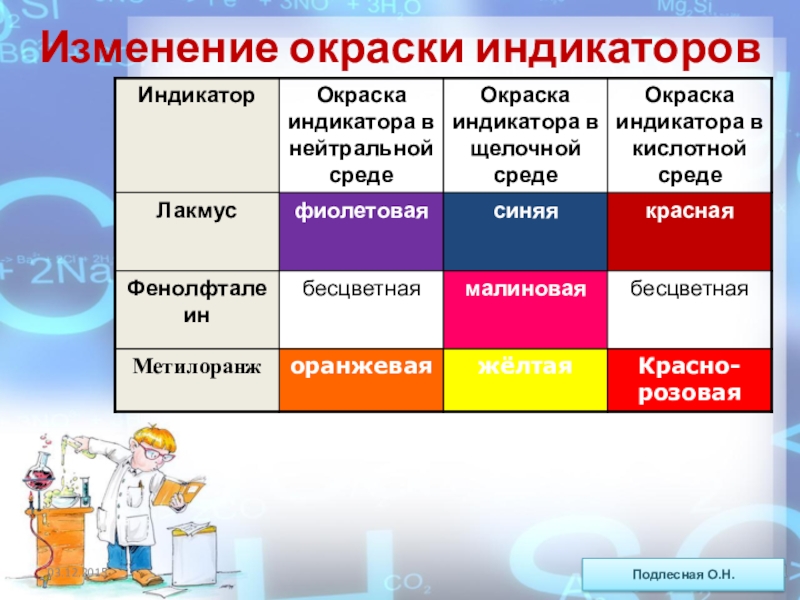
ежегодно выпадает на Землю ~100 млн тонн НNO3).
б) Кислоты в
нашей пище(Фрукты, овощи, молочные продукты, соусы, приправы, лекарства).
в) Кислоты в природе
(Муравьи, крапива, гусеницы, жуки- стреляют уксусной и серной кислотой; тысяченожки испускают пары синильной кислоты; мухоморы, лишайники, более 800 видов растений вырабатывают синильную кислоту).
Подлесная О.Н.