Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гидролиз неорганических солей
Содержание
- 1. Гидролиз неорганических солей
- 2. Словарь Гидролиз – реакция обмена между растворимыми солями
- 3. Классификация солейсоли1 тип: образованы сильным основанием и
- 4. Классификация солейЗадание1. Разделите предложенные формулы солей на четыре
- 5. Соли, образованные слабым основанием и сильной кислотойCuCl2
- 6. Соли, образованные сильным основанием и слабой кислотойNa2
- 7. Соли, образованные сильным основанием и сильной кислотойNaNO3
- 8. Соли, образованные слабым основанием и слабой
- 9. Проверь себяЗадание 2:Определите окраску лакмуса в растворах
- 10. Проверь себя Задание 3:Исключите лишнюю соль из списка:А)
- 11. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Гидролиз неорганических солей
Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска
Шапошникова
Т.С.
Слайд 2Словарь
Гидролиз – реакция обмена между растворимыми солями и водой
Сильные кислоты
– кислоты, являющиеся сильными электролитами (H2SO4, HCl, HNO3, HBr, HI,
HClO4 и другие)Слабые кислота – кислоты, являющиеся слабыми электролитами (H2CO3, H2SO3, H2S, H2SiO3, H3PO4 и другие)
Сильные основания – сильные электролиты - щелочи (NaOH, KOH, Ca(OH)2 и другие)
Слабые основания – нерастворимые основания, слабые электролиты (Cu(OH)2, Al(OH)3 и другие)
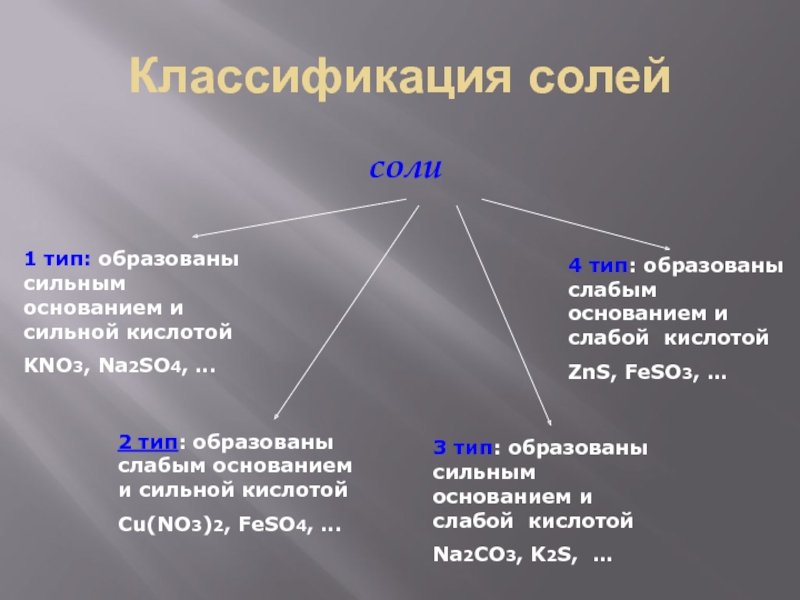
Слайд 3Классификация солей
соли
1 тип: образованы сильным основанием и сильной кислотой
KNO3, Na2SO4,
…
2 тип: образованы слабым основанием и сильной кислотой
Сu(NO3)2, FeSO4, …
3
тип: образованы сильным основанием и слабой кислотойNa2CO3, K2S, …
4 тип: образованы слабым основанием и слабой кислотой
ZnS, FeSO3, …
Слайд 4Классификация солей
Задание1.
Разделите предложенные формулы солей на четыре типа, объясните свой
выбор:
BaCl2, ZnSO4, CuCl2, Na2SO4, Al(NO3)3, MnCl2, Cr2(SO4)3, K2SiO3, LiNO3, Co(NO2)2,MgSO3
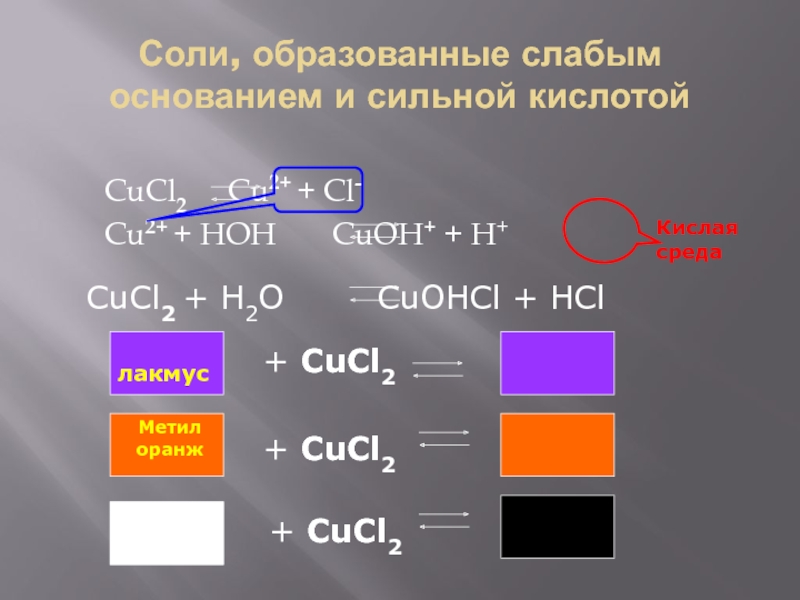
Слайд 5Соли, образованные слабым основанием и сильной кислотой
CuCl2 Cu2+ +
Cl-
Cu2+ + HOH CuOH+ + H+
Кислая среда
CuCl2 + H2O
CuOHCl + HCl лакмус
+ CuCl2
+ CuCl2
+ CuCl2
Метил
оранж
Фенол
фталеин
Слайд 6Соли, образованные сильным основанием и слабой кислотой
Na2 CO3
Na+ + CO32-
CO32- + HOH HCO3- + OH-
Щелочная
средаNa2 CO3 + H2O NaHCO3 + NaOH
лакмус
+ Na2 CO3
+ Na2 CO3
+ Na2 CO3
Метил
оранж
Фенол
фталеин
Слайд 7Соли, образованные сильным основанием и сильной кислотой
NaNO3
Na+ + NO3 -
Нейтральная среда
лакмус
+ NaNO3
+ NaNO3
+ NaNO3
Метил-
оранж
Фенол-
фталеин
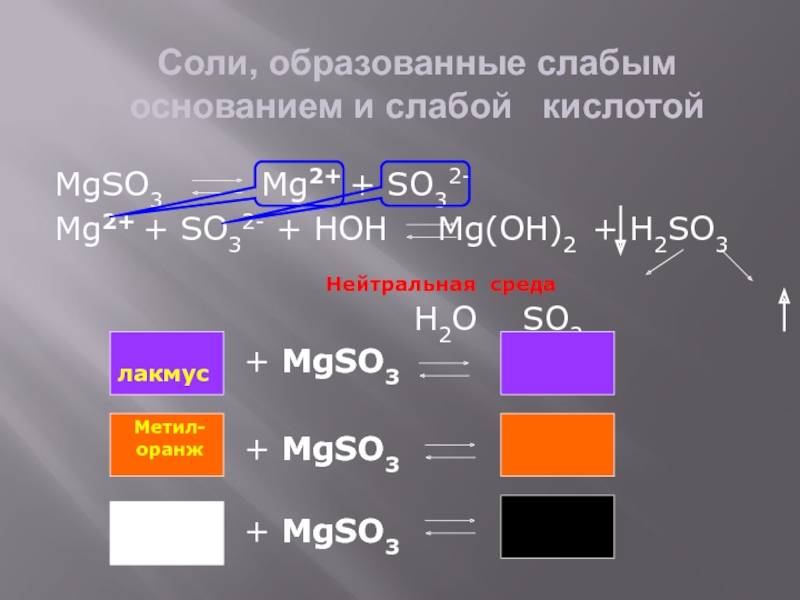
Слайд 8Соли, образованные слабым основанием и слабой кислотой
MgSO3
Mg2+ + SO32-
Mg2+ + SO32- + HOH
Mg(OH)2 + H2SO3H2O SO2
Нейтральная среда
лакмус
+ MgSO3
+ MgSO3
+ MgSO3
Метил-
оранж
Фенол-
фталеин
Слайд 9Проверь себя
Задание 2:
Определите окраску лакмуса в растворах солей:
Ba(NO3)2, FeCl3, LiNO2,
CoSO4,
Na2SiO3, ZnS, KCl
Приведите примеры возможных реакций (по одному для
каждого типа соли)Слайд 10Проверь себя
Задание 3:
Исключите лишнюю соль из списка:
А) ZnCl2, CuSO4, KNO3,
Ni(NO3)2
Б) K2S, AgNO3, CrCl3, Pb(NO3)2
В) Na2S, CaCl2, Li3PO4, K2CO3
Г) KNO3,
MgBr2, Na2SO4, CaI2Д) SnCl2, Al(NO3)3, PbSO4, Fe2(SO4)3
Напишите уравнения реакций гидролиза выбранных вами солей