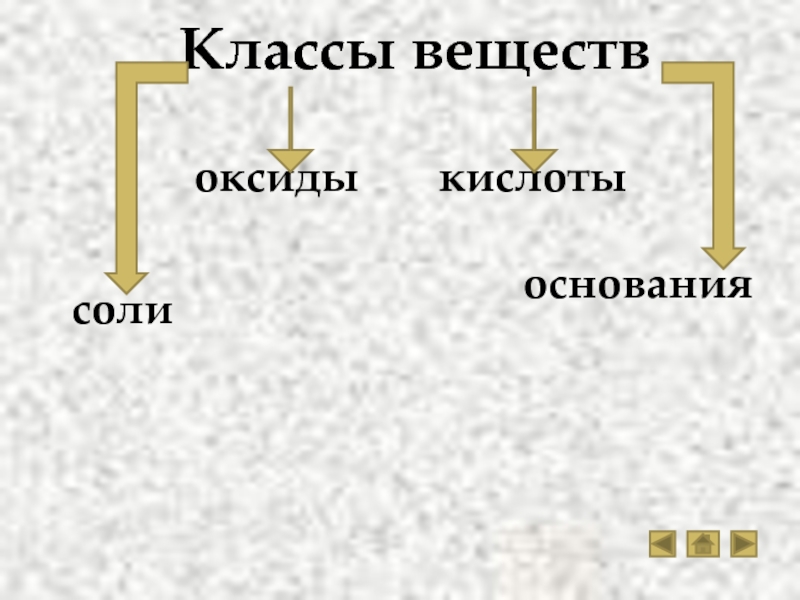
веществ
Кислоты
Классификация кислот
Химические свойства кислот
Основания
Классификация оснований
Свойства оснований
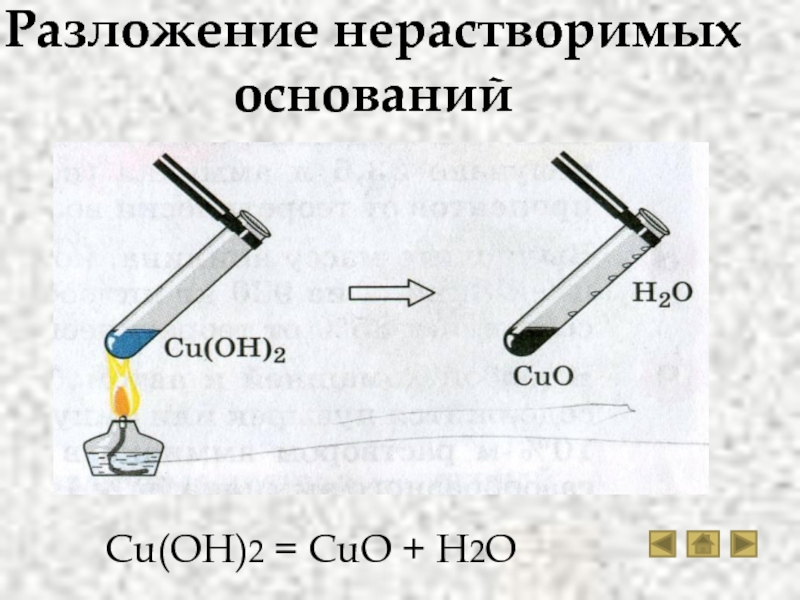
Разложение нерастворимых оснований
Соли
Разнообразие солей
Свойства солей
Оксиды
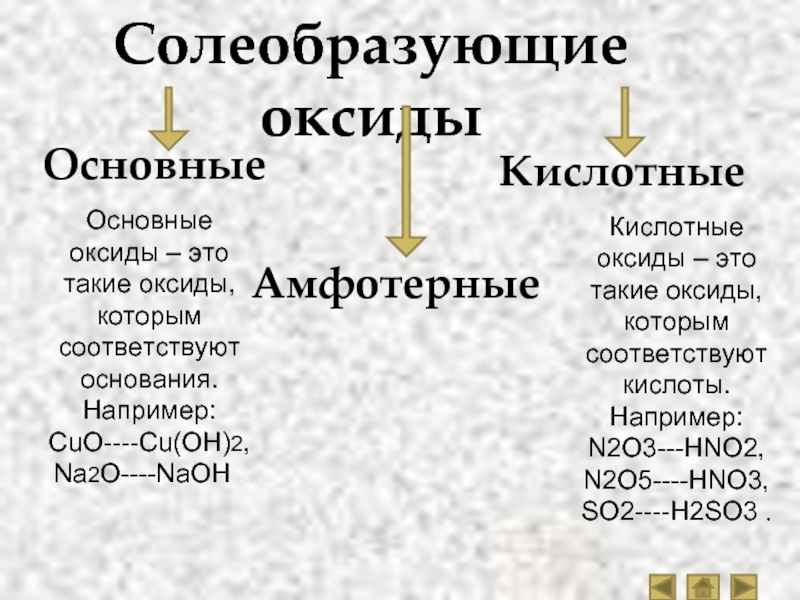
Солеобразующие
оксидыТипичные реакции основных оксидов
Типичные реакции кислотных оксидов