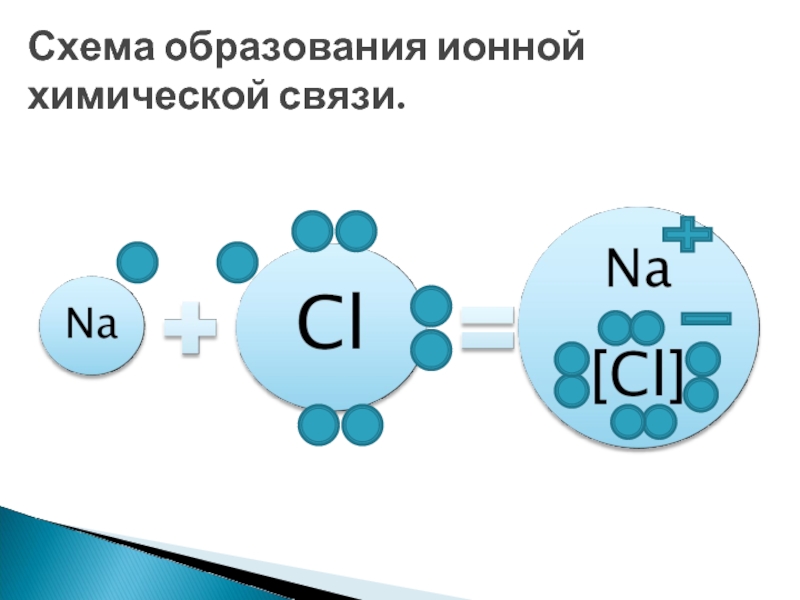
данном уроке разобрать причины и механизмы образования ионной связи.
Познакомить: с
типами ионных кристаллических решеток; с физическими свойствами веществ кристаллических решеток.Знать основные понятия: химическая связь, ионная химическая связь, ионные кристаллические решетки.
Уметь определять ионную связь.
Цель урока: сформировать понятие ионная химическая связь.