Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
НЕМЕТАЛЛЫ природные соединения применения продуктов их переработки
Содержание
- 1. НЕМЕТАЛЛЫ природные соединения применения продуктов их переработки
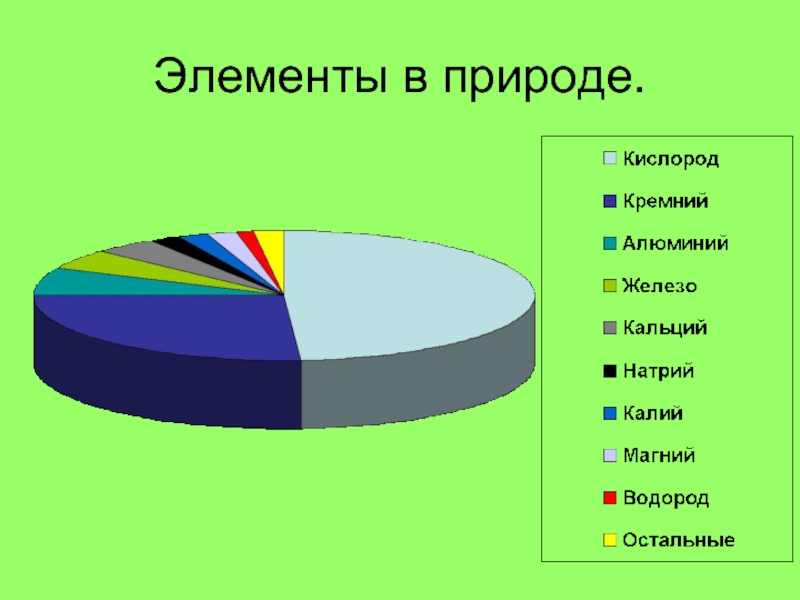
- 2. Элементы в природе.
- 3. Нахождение в природе.Самородные элементыСера Графит САлмаз САзот и кислород, инертные газы в составе воздуха
- 4. Нахождение в природе← Апатиты РГалит NaCl →← FeS2 пиритКварц SiO2 →
- 5. Неметаллы - это химические элементы, которые могут
- 6. Соединения неметаллов.Оксиды – только кислотные SO3,
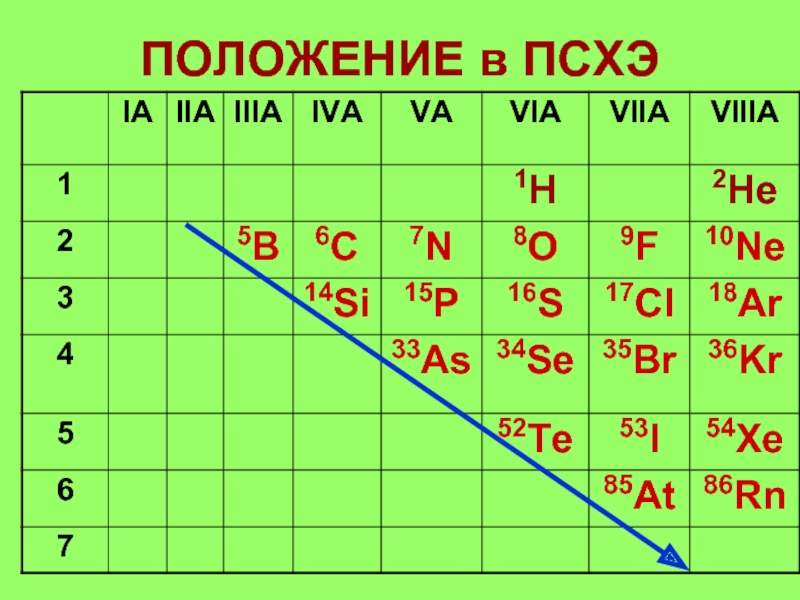
- 7. ПОЛОЖЕНИЕ в ПСХЭ
- 8. ЭЛЕМЕНТЫ - IA,IIIA,IVAН
- 9. ПНИКТОГЕНЫ -VA
- 10. ХАЛЬКОГЕНЫ -VIA
- 11. ГАЛОГЕНЫ -VIIA
- 12. ИНЕРТНЫЕ ГАЗЫ-VIIIA
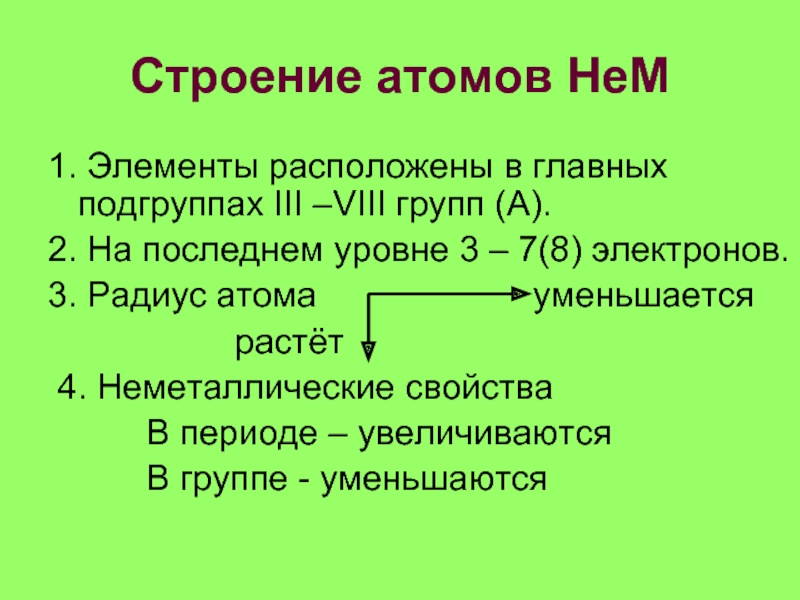
- 13. Строение атомов НеМ1. Элементы расположены в главных
- 14. Строение атомов НеМ5. Высокая электроотрицательность.6. Принимают электроны
- 15. Физические свойстваАгрегатное состояние.Газообразные – азот, кислород, хлор,
- 16. Строение неметаллов. Молекулярное (НеМ), где Инертные газы
- 17. Кислород, водород – пример газообразных бесцветных неметаллов
- 18. Большинство неметаллов имеют твёрдое агрегатное состояниеСера – кристаллическое вещество жёлтого цветаКрасный фосфорУглерод (уголь)
- 19. Неметаллы малорастворимы в водеУголь ФосфорСера не смачивается водой
- 20. Химические свойства.1. Реагируют с металлами.2. С кислородом.3. С водородом.4. С кислотами.5. Со щелочами.6. С солями.
- 21. Скачать презентанцию
Элементы в природе.
Слайды и текст этой презентации
Слайд 3Нахождение в природе.
Самородные элементы
Сера
Графит С
Алмаз С
Азот и кислород, инертные
газы в составе воздуха
Слайд 5Неметаллы - это химические элементы, которые могут проявлять свойства как
окислителя ( принимают электроны), так и восстановителя (отдают электроны).
НеМ –
элементы с высокой ОЭО (2 - 4)Исключения : фтор – только окислитель,
инертные газы – могут только отдавать электроны.
Гелий, неон и аргон – соединений не образуют.
Слайд 6Соединения неметаллов.
Оксиды – только кислотные
SO3, SO2, CO2
и другие.
(кроме NO и CO –безразличные)
Гидроксиды – только кислоты
H2SO4,
H2SO3,H2CO3 и другиеОбразуют летучие соединения с водородом HCl, NH3…
Слайд 13Строение атомов НеМ
1. Элементы расположены в главных подгруппах III –VIII
групп (А).
2. На последнем уровне 3 – 7(8) электронов.
3. Радиус
атома уменьшается растёт
4. Неметаллические свойства
В периоде – увеличиваются
В группе - уменьшаются
Слайд 14Строение атомов НеМ
5. Высокая электроотрицательность.
6. Принимают электроны и отдают.
7. НеМ
→ кислотный оксид→кислота
8. Летучие водородные соединения
(кислоты, основания
и безразличные)Слайд 15Физические свойства
Агрегатное состояние.
Газообразные – азот, кислород, хлор, инертные газы, водород.
Жидкий – бром,
Твёрдые – сера, фосфор, углерод…
Растворимость в воде.
Нерастворимы.
Отношение к
электрическому току.Неэлектропроводные: сера, кислород…
Проводники: графит
Полупроводники: кремний
Слайд 16Строение неметаллов.
Молекулярное (НеМ), где
Инертные газы He, Ar, Ne…
H2, Cl2,
N2…
P4 белый
Pn красный
Атомное строение
(С)n -алмаз, графит;
(Si)n кремний;
(B)n бор
Слайд 18Большинство неметаллов имеют твёрдое агрегатное состояние
Сера – кристаллическое вещество жёлтого
цвета
Красный фосфор
Углерод (уголь)
Слайд 20Химические свойства.
1. Реагируют с металлами.
2. С кислородом.
3. С водородом.
4. С
кислотами.
5. Со щелочами.
6. С солями.
Теги