Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химические реакции 11 класс
Содержание
- 1. Химические реакции 11 класс
- 2. Цель:1. Систематизировать и закрепить знания учащихся по
- 3. Химическая реакция — превращение одного или нескольких исходных
- 4. Химические реакции происходят при смешении или
- 5. Взаимодействие молекул между собой происходит по цепному
- 6. КлассификацияСуществует большое количество признаков, по которым можно классифицировать химические реакции.
- 7. По фазовому составу реагирующей системыГомогенные гомофазные реакции.В
- 8. Гетерогенные гетерофазные реакции.
- 9. Гетерогенные гомофазные реакции. Такие реакции протекают в
- 10. Гомогенные гетерофазные реакции. Реагенты и продукты в
- 11. По изменению степеней окисления реагентовОкислительно-восстановительные реакции, в
- 12. Пример реакции диспропорционирования — реакция разложения нитрата аммония
- 13. Не окислительно-восстановительные реакции — соответственно, реакции, в которых
- 14. По тепловому эффекту реакцииВсе реакции сопровождаются тепловыми
- 15. Экзотермические реакции, которые идут с выделением тепла,
- 16. По типу превращений реагирующих частиц Соединения: Разложения: Замещения: Обмена (тип реакции - нейтрализация):
- 17. С помощью химических реакций можно получать практически
- 18. Слайд 18
- 19. Источники информации: 1) О.С. Габриелян, Г.Г. Лысова Химия 11 класс2) http://ru.wikipedia.org/wiki3) http://images03.olx.ru/ui/4/47/75/70154275_1---.jpg4) http://gusev-politeh.ru/uploads/posts/2011-11/1320844513_chemistry.jpg5) http://www.tigrulki.ru/wp-content/uploads/2010/02/uh.jpg6) http://www.lomonintek.ru/img/upload/istoricheskie-opyty-himii.jpg
- 20. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Цель:
1. Систематизировать и закрепить знания учащихся по теме «Химические реакции»
Задачи
:
В интересной форме познакомить учащихся с типами химических реакций
Поддерживать
интерес к изучаемому материалуСлайд 3Химическая реакция — превращение одного или нескольких исходных веществ в отличающиеся
от них по химическому составу или строению вещества (продукты реакции).
Химическая реакция кислот.В отличие от ядерных реакций, при химических реакциях ядраВ отличие от ядерных реакций, при химических реакциях ядра атомовВ отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.
Слайд 4
Химические реакции происходят при смешении или физическом контакте реагентов
самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции),
электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции)Слайд 5Взаимодействие молекул между собой происходит по цепному маршруту: ассоциация –
электронная изомеризация – диссоциация, в котором активными частицами являются радикалы,
ионы, координационно-ненасыщенные соединения. Скорость химической реакции определяется концентрацией активных частиц и разницей между энергиями связи разрываемой и образуемой.Слайд 6Классификация
Существует большое количество признаков, по которым можно классифицировать химические реакции.
Слайд 7По фазовому составу реагирующей системы
Гомогенные гомофазные реакции.
В таких реакциях реакционная
смесь является гомогенной, а реагенты и продукты принадлежат одной и
той же фазе. Примером таких реакций могут служить реакции ионного обмена, например, нейтрализация кислоты и щелочи в растворе:
NaOH(раств.) + HCl(раств.) → NaCl(раств.) + H2O(жидкость)
Слайд 8Гетерогенные гетерофазные реакции. В этом случае
реагенты находятся в разном фазовом состоянии, продукты реакции также могут
находиться в любом фазовом состоянии. Реакционный процесс протекает на границе раздела фаз. Примером может служить реакция солей угольной кислоты (карбонатов) с кислотами Бренстеда:
Ca CaCO3(тв.) + 2HCl(раств.) → CaCl2(раств.) + CO2(газ) + H2O(жид.)
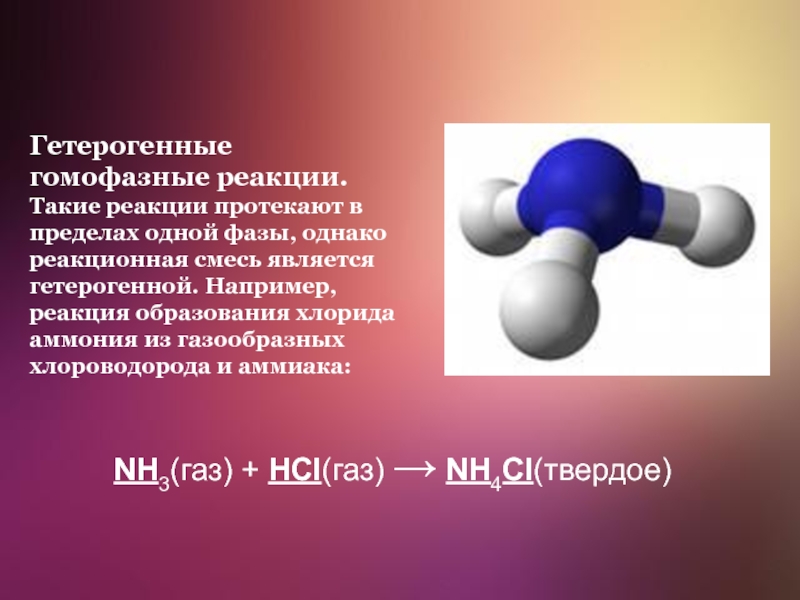
Слайд 9Гетерогенные гомофазные реакции. Такие реакции протекают в пределах одной фазы,
однако реакционная смесь является гетерогенной. Например, реакция образования хлорида аммония
из газообразных хлороводорода и аммиака:
NH3(газ) + HCl(газ) → NH4Cl(твердое)
Слайд 10Гомогенные гетерофазные реакции. Реагенты и продукты в такой реакции существуют
в пределах одной фазы, однако реакция протекает на поверхности раздела
фаз. Примером таких реакций являются некоторые гетерогенно-каталитические реакции, например, реакция синтеза аммиака из водорода и азота:N2(газ) + 3H2(газ) → 2 NH3(газ) (катализатор Pt)
Слайд 11По изменению степеней окисления реагентов
Окислительно-восстановительные реакции, в которых атомы одного
элемента (окислителя) восстанавливаются, то есть понижают свою степень окисления, а
атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления. Частным случаем окислительно-восстановительных реакций являются реакции диспропорционирования, в которых окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в разных степенях окисления.Пример окислительно-восстановительной реакции — горение водорода (восстановитель) в кислороде (окислитель) с образованием воды:
2H2 + O2 = 2H2O
Слайд 12Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем
в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот
(-3) катиона аммония:NH4NO3 = N2O + 2H2O (до 250 °C)
Слайд 13
Не окислительно-восстановительные реакции — соответственно, реакции, в которых не происходит изменения
степеней окисления атомов, например:
NH3+ HCl → NH4Cl
NNaOH + HNaOH +
HCl → N NaCl + H2OСлайд 14По тепловому эффекту реакции
Все реакции сопровождаются тепловыми эффектами. При разрыве
химических связей в реагентах выделяется энергия, которая, в основном, идет
на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделитьСлайд 15Экзотермические реакции, которые идут с выделением тепла, (положительный тепловой эффект)
например, горение водорода:
Эндотермические реакции в ходе которых тепло поглощается (отрицательный
тепловой эффект) из окружающей среды, например:2H2 + O2 = 2H2O
2H2O = 2H2 + O2