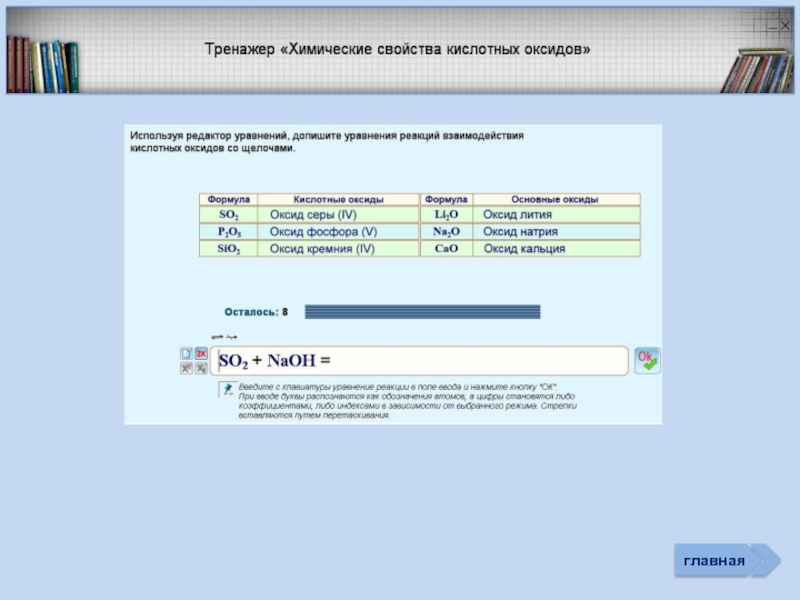
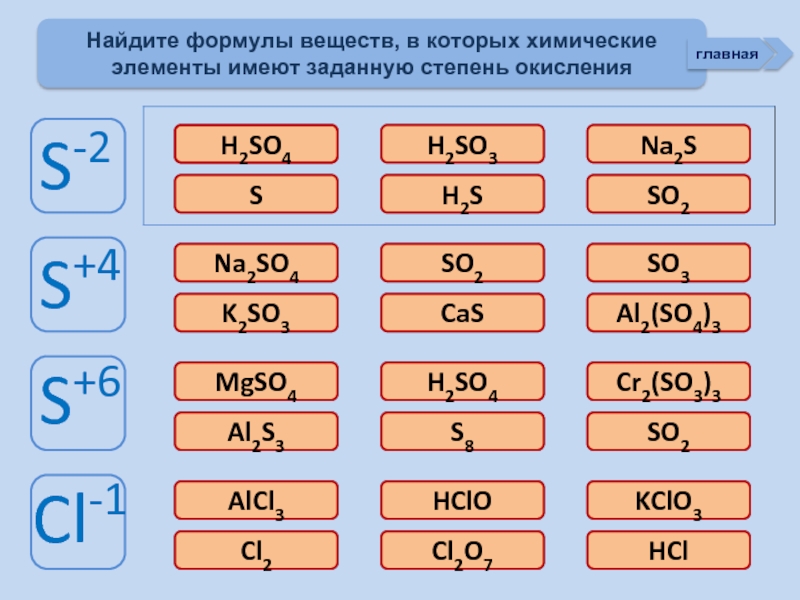
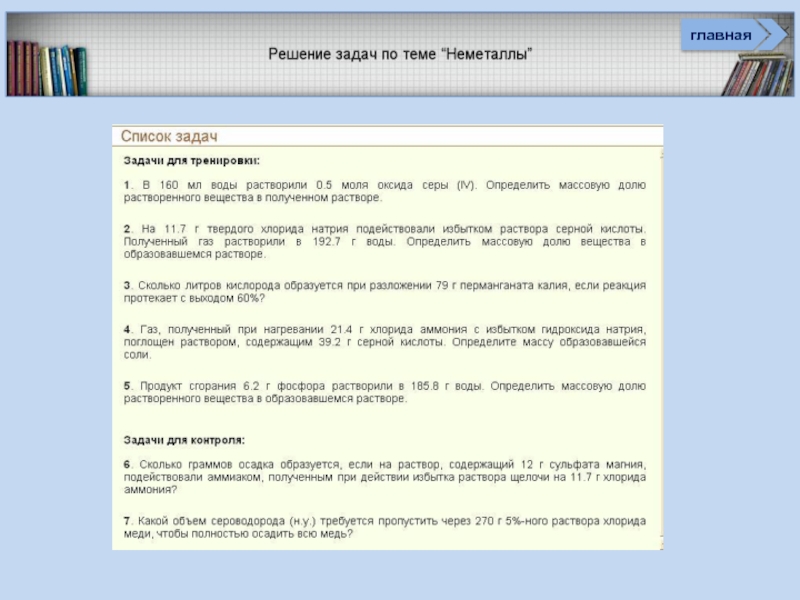
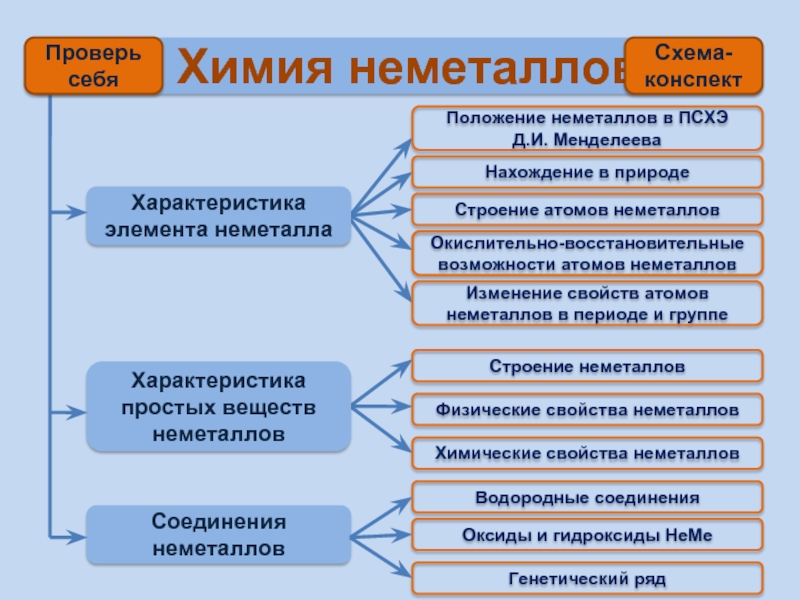
веществ неметаллов
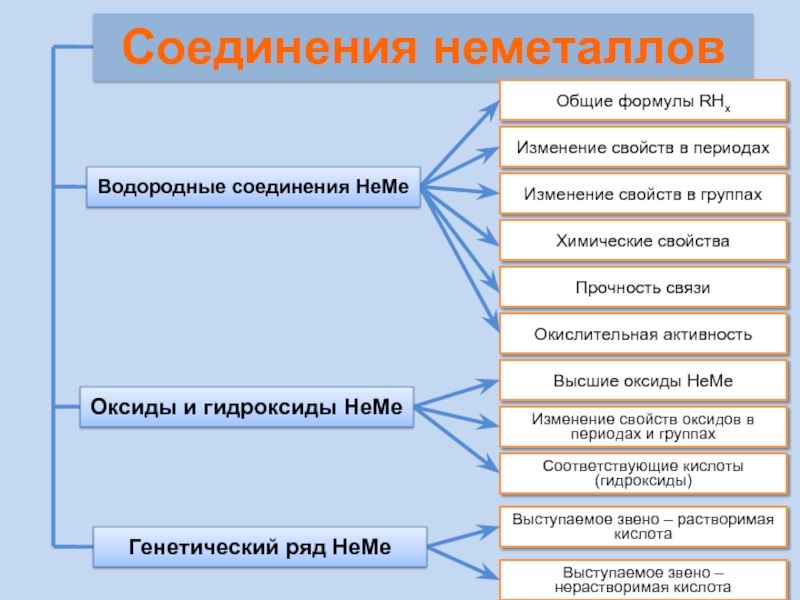
Соединения неметаллов
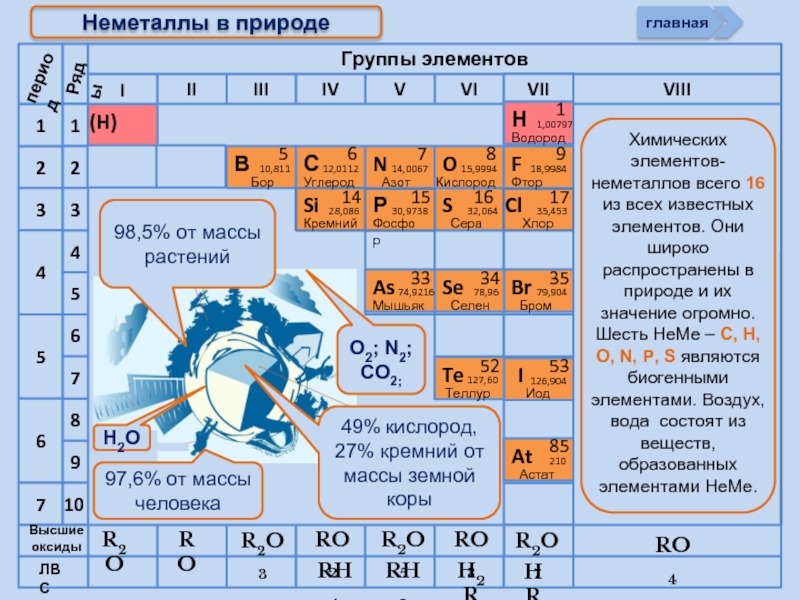
Положение неметаллов в ПСХЭ
Д.И. МенделееваСтроение атомов неметаллов
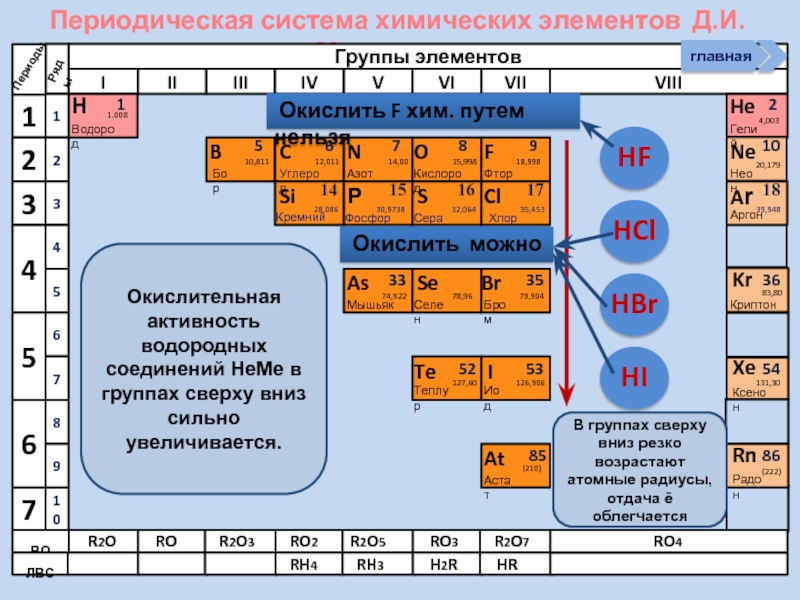
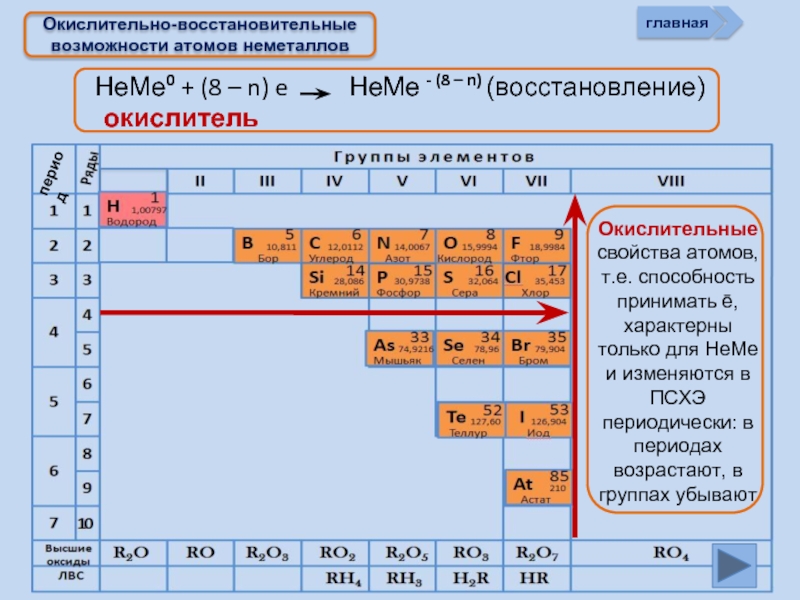
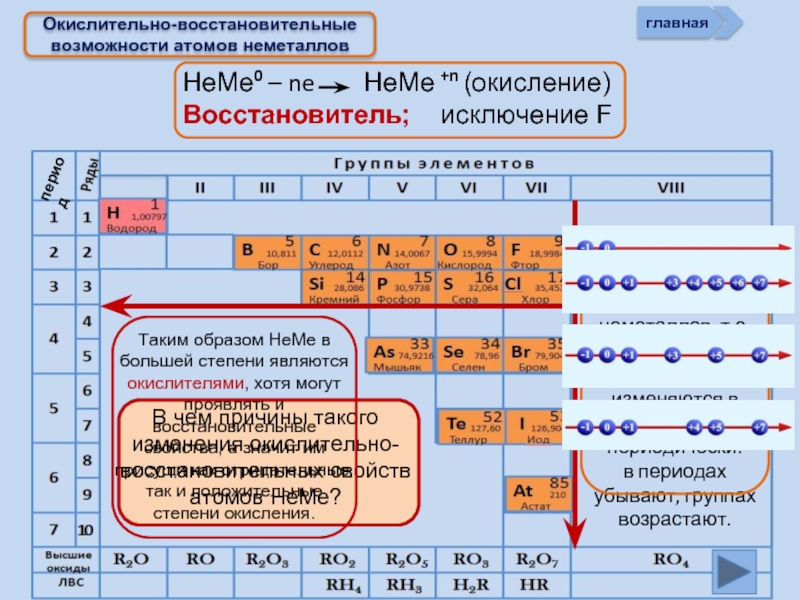
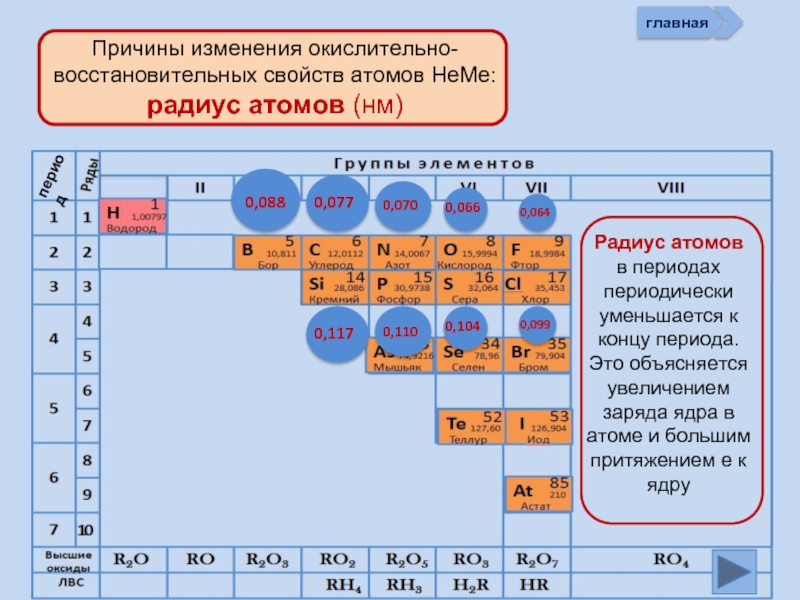
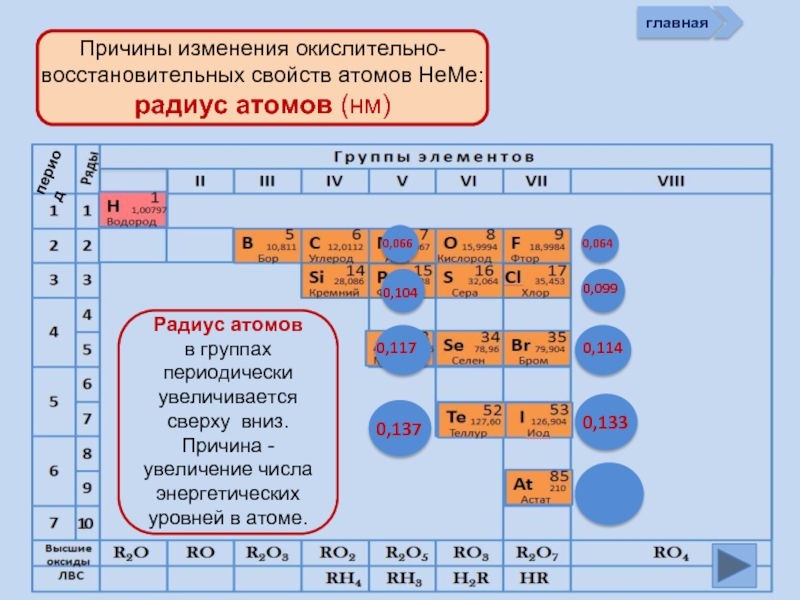
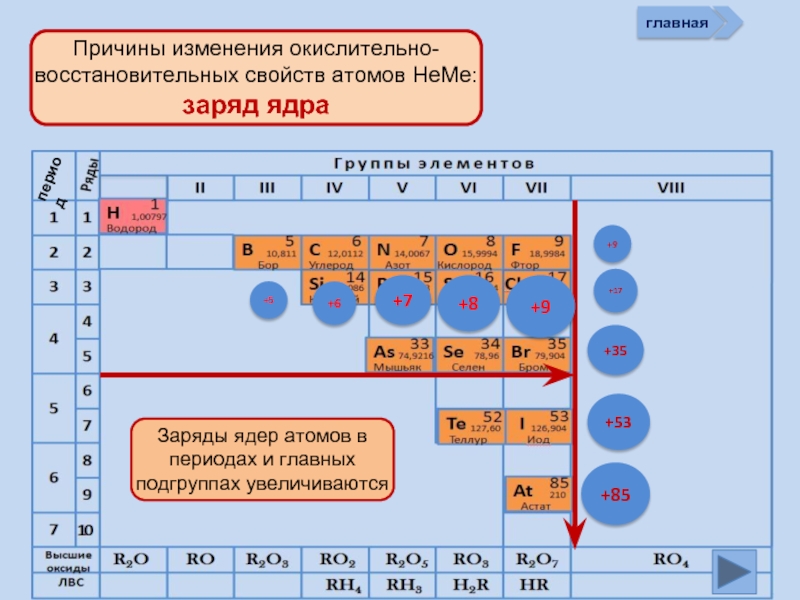
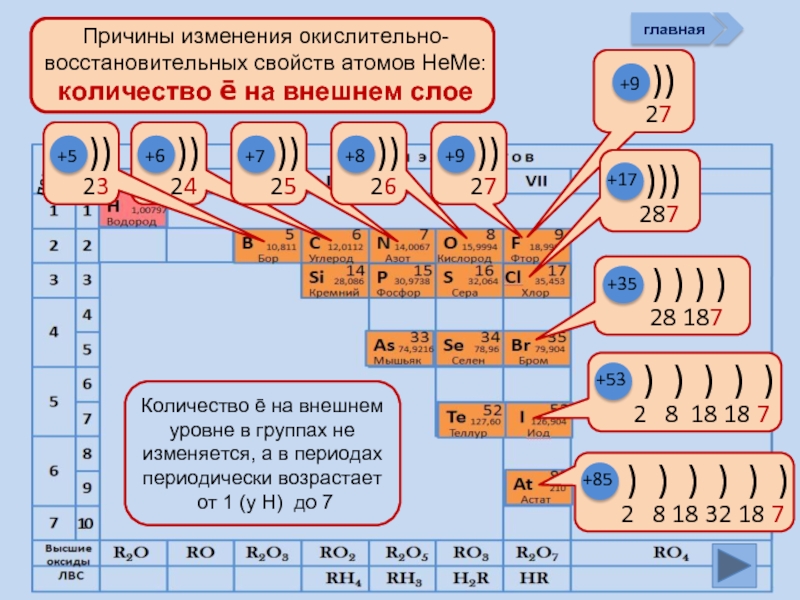
Окислительно-восстановительные возможности атомов неметаллов
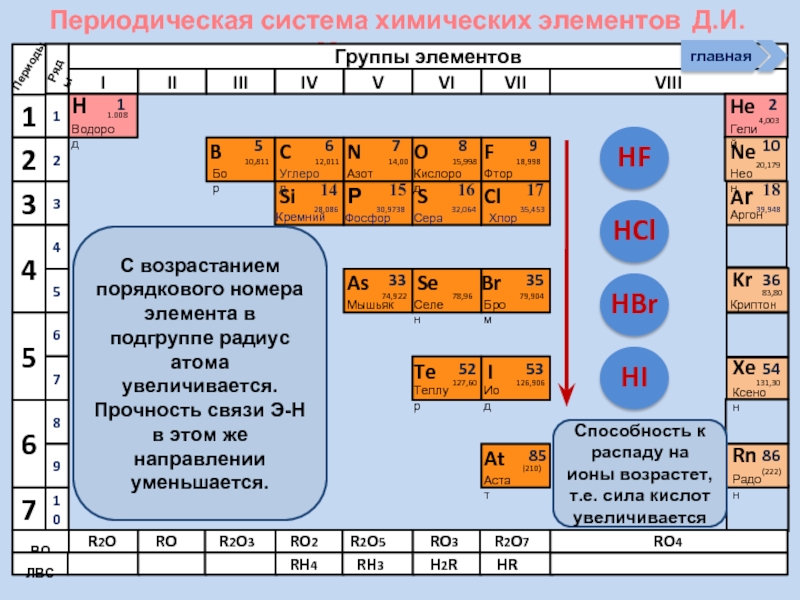
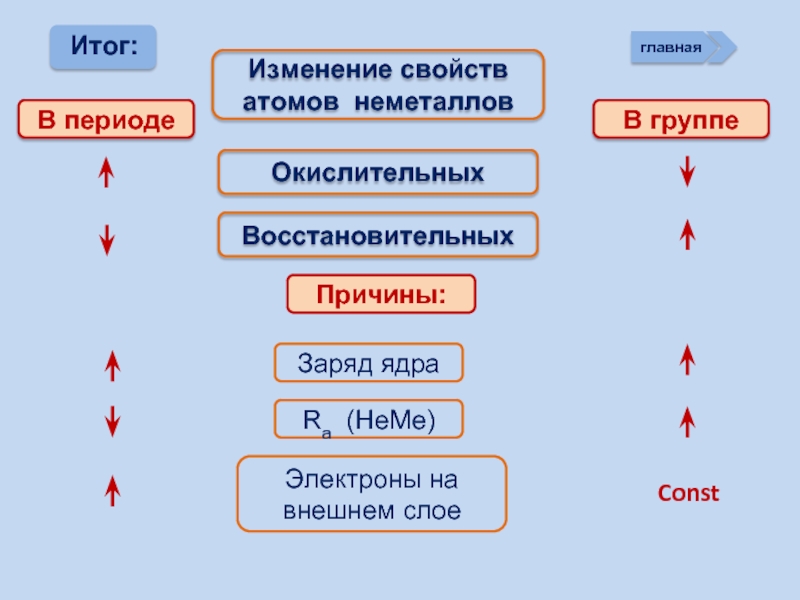
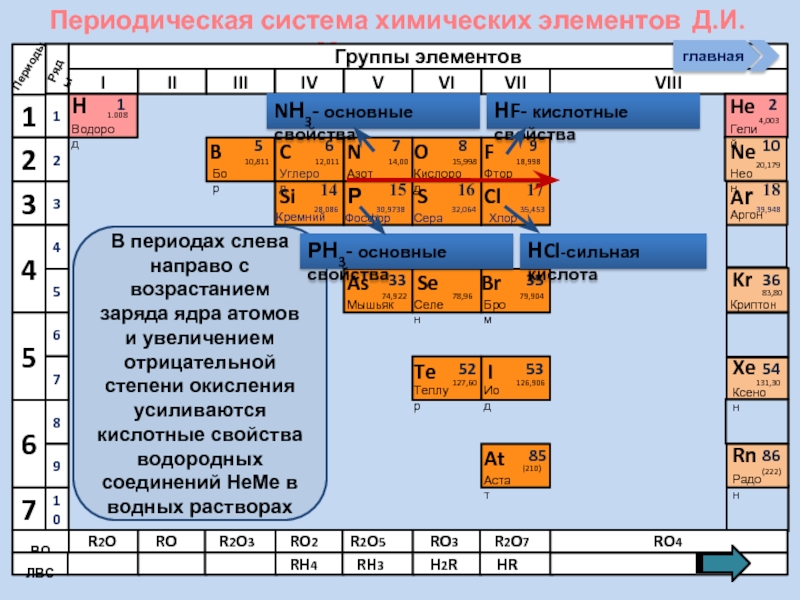
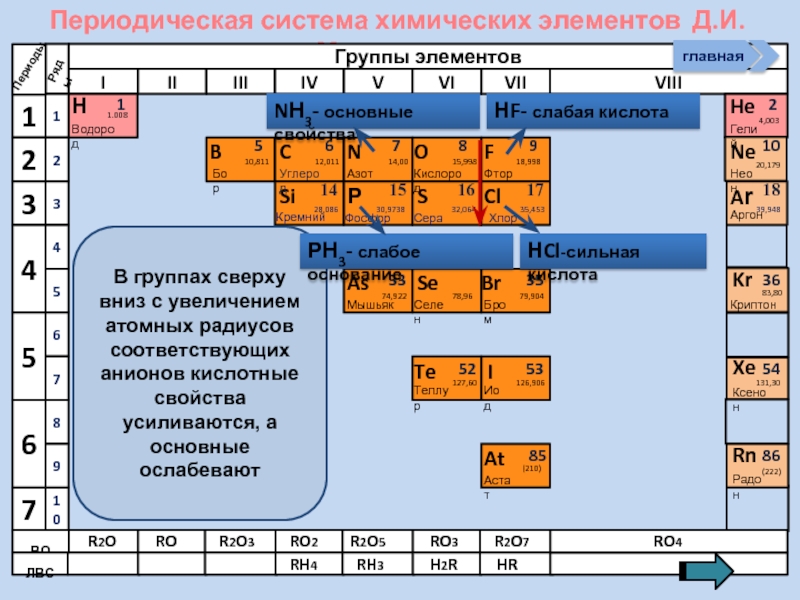
Изменение свойств атомов неметаллов в периоде и группе
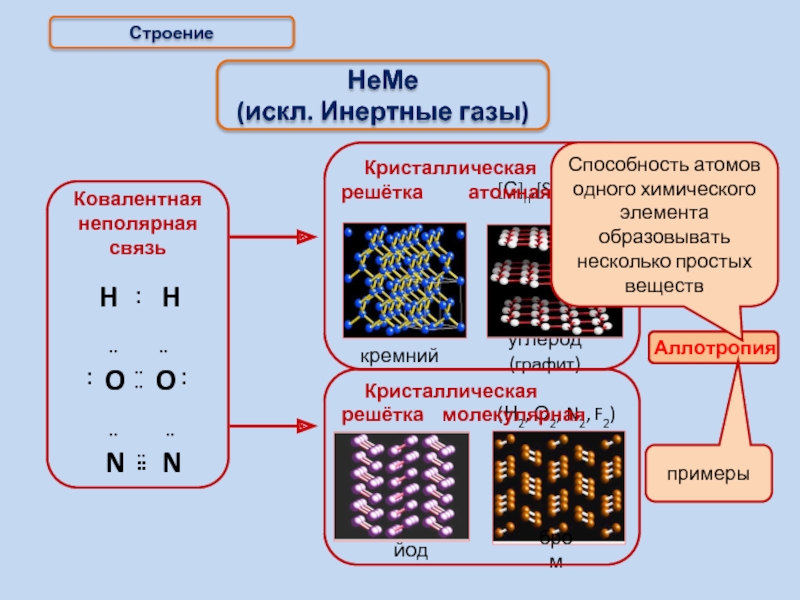
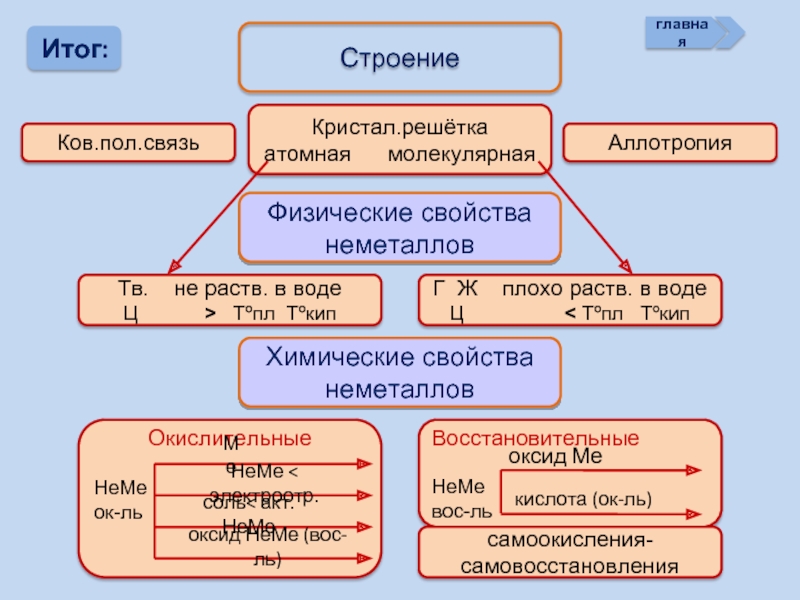
Строение неметаллов
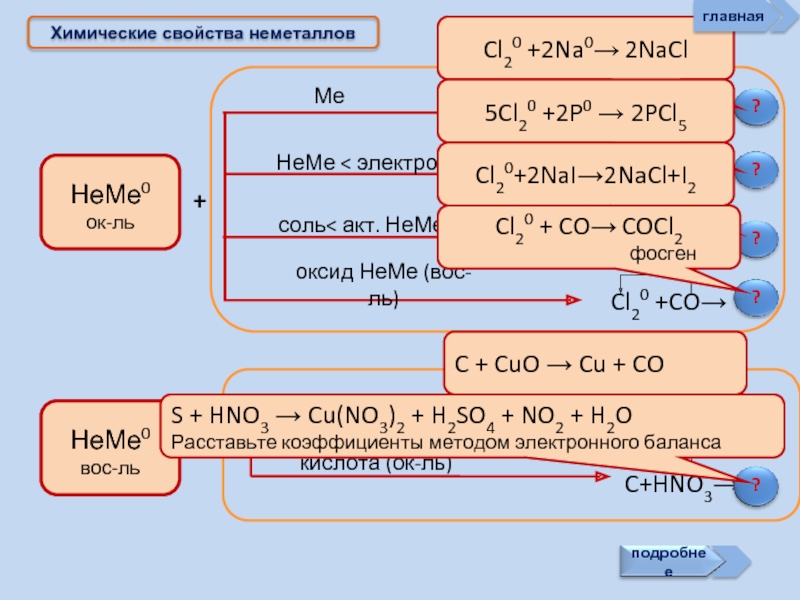
Химические свойства неметаллов
Физические свойства неметаллов
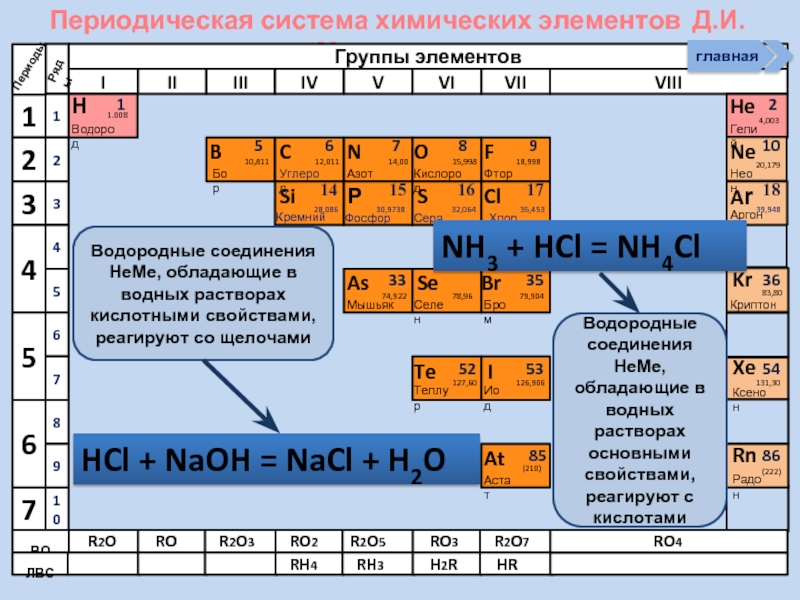
Водородные соединения
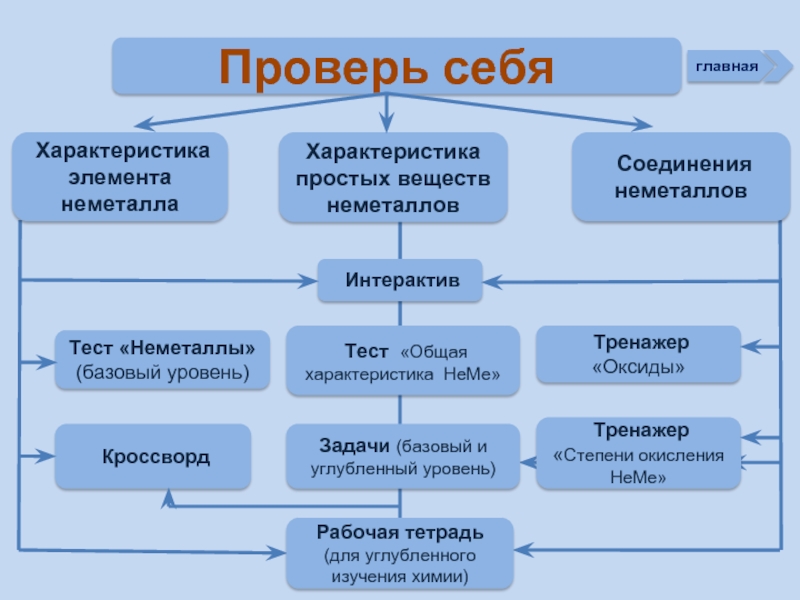
Проверь себя
Нахождение в природе
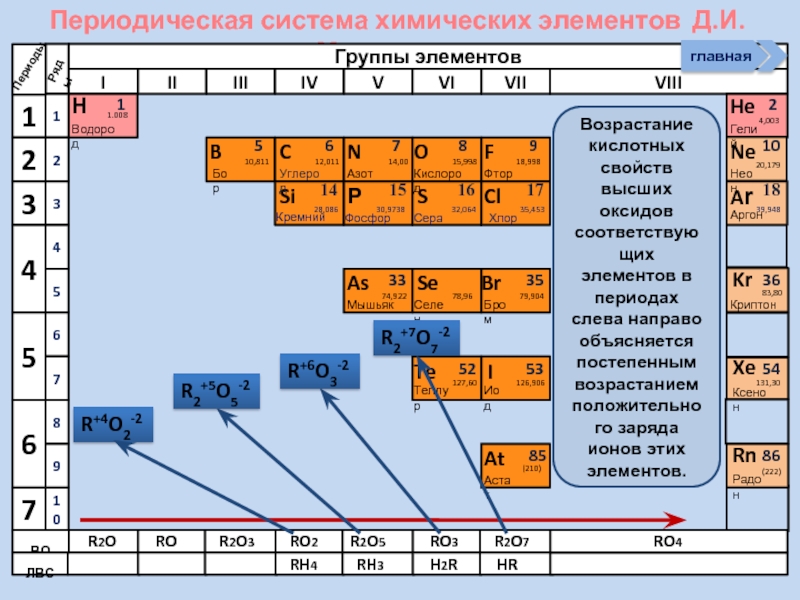
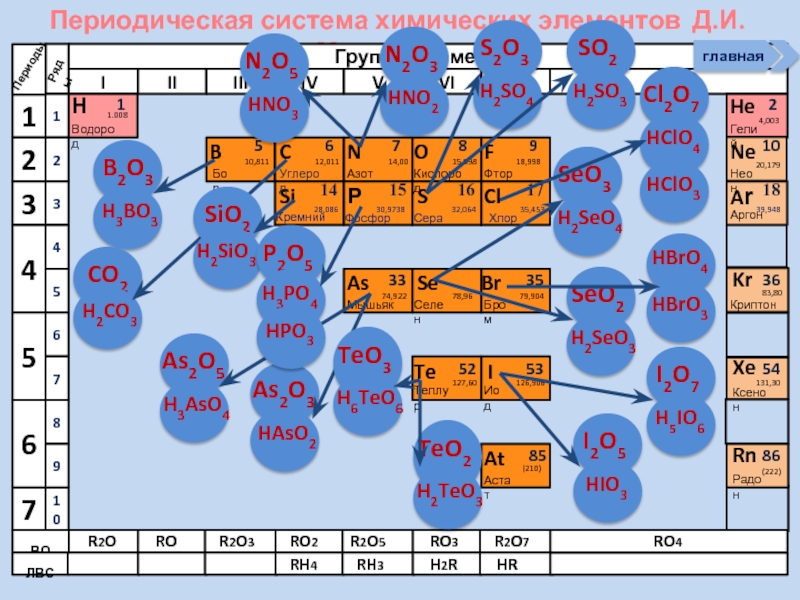
Оксиды и гидроксиды НеМе
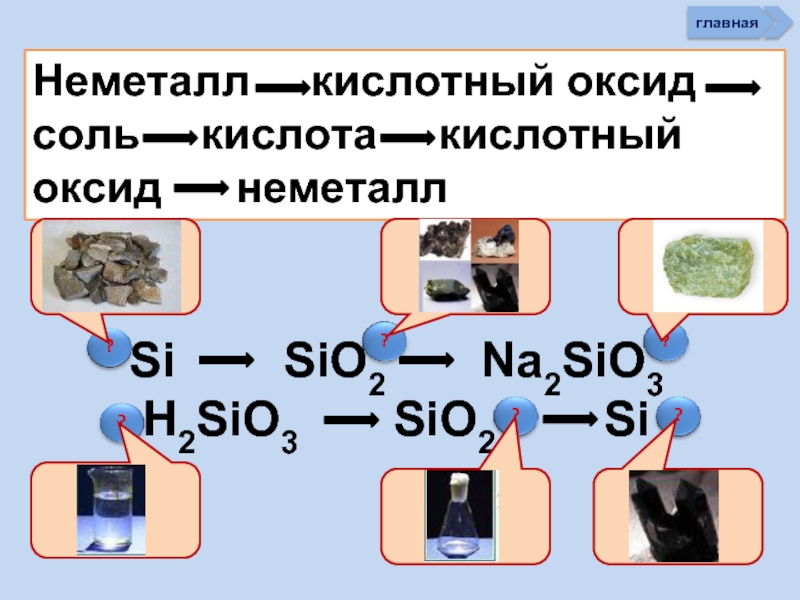
Генетический ряд
Схема- конспект



![Химия неметаллов Аллотропия[Р]n а.кр.р.[Р]4 м.кр.р. Аллотропия[Р]n а.кр.р.[Р]4 м.кр.р.](/img/thumbs/518f810400ed0ea596e0e7d3bf66c1aa-800x.jpg)




![Химия неметаллов Процесс растворения кислот в водеНОН+НFННOН+F[]-2-1-1::::::::::::::::Или сокращенноН2О-2+НF-1Н3О++F-1Фтороводород в водном растворе отщепляет положительные Процесс растворения кислот в водеНОН+НFННOН+F[]-2-1-1::::::::::::::::Или сокращенноН2О-2+НF-1Н3О++F-1Фтороводород в водном растворе отщепляет положительные ионы водорода, т.е. проявляет кислотные свойства.](/img/thumbs/da046e1db0dfc8a310953684b61c874d-800x.jpg)
![Химия неметаллов Процесс растворения аммиака в водеНОН+НNННNН+[]-2-3::::::::::::::::Или сокращенноН2О-2+Н3N-3NН4++OH-+НН[]-ННОАтом азота имеет неподеленную электронную пару, Процесс растворения аммиака в водеНОН+НNННNН+[]-2-3::::::::::::::::Или сокращенноН2О-2+Н3N-3NН4++OH-+НН[]-ННОАтом азота имеет неподеленную электронную пару, а атом водорода – свободную орбиталь.](/img/thumbs/57b68ab4676b2b53615cdd8286467a21-800x.jpg)