Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Хлороводород. Соляная кислота
Содержание
- 1. Хлороводород. Соляная кислота
- 2. Хлороводород HClHCl – это бесцветный газ с
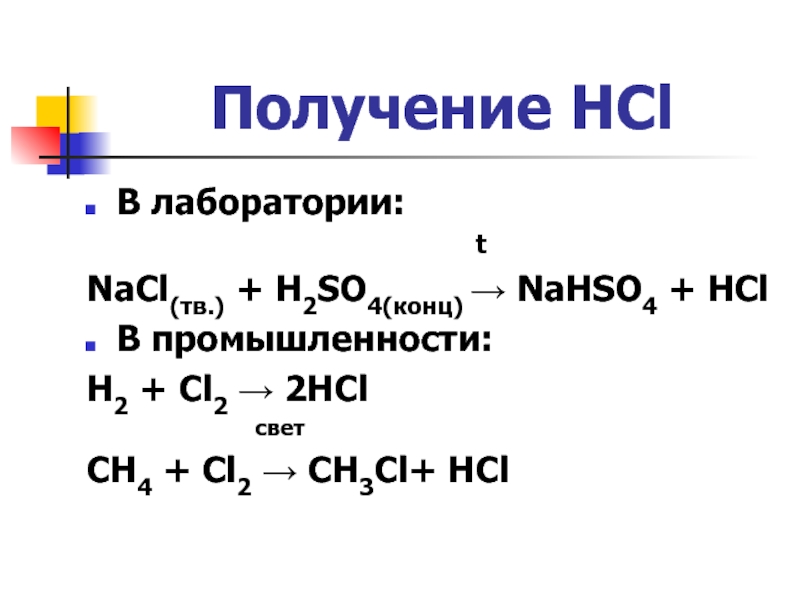
- 3. Получение HClВ лаборатории:
- 4. Соляная кислота HClСоляная кислота сильная, т.е. в
- 5. Химические свойстваКислотные свойстваА. Взаимодействие с металлами, стоящими
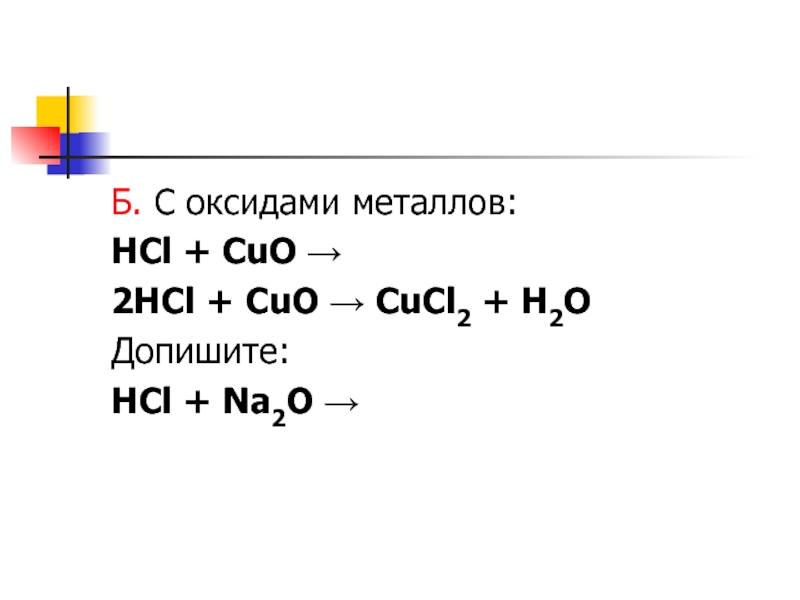
- 6. Б. С оксидами металлов:HCl + CuO →
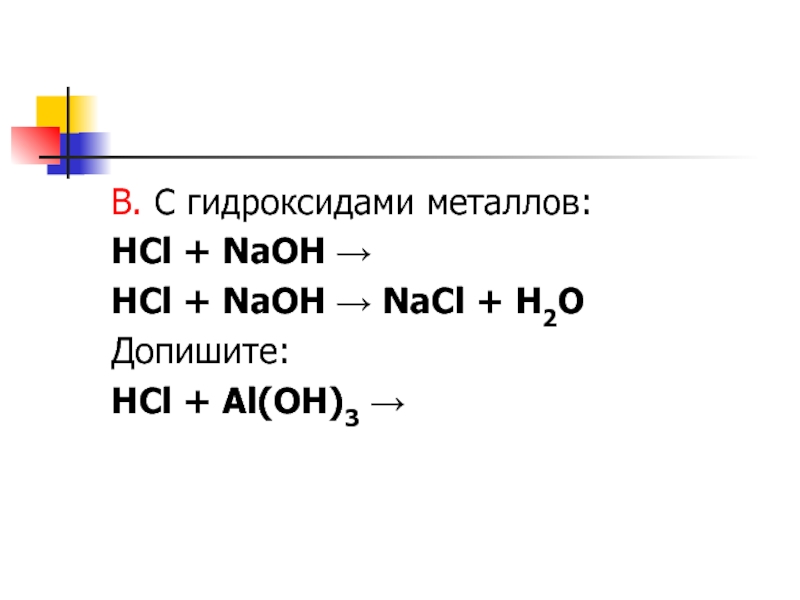
- 7. В. С гидроксидами металлов:HCl + NaOH →
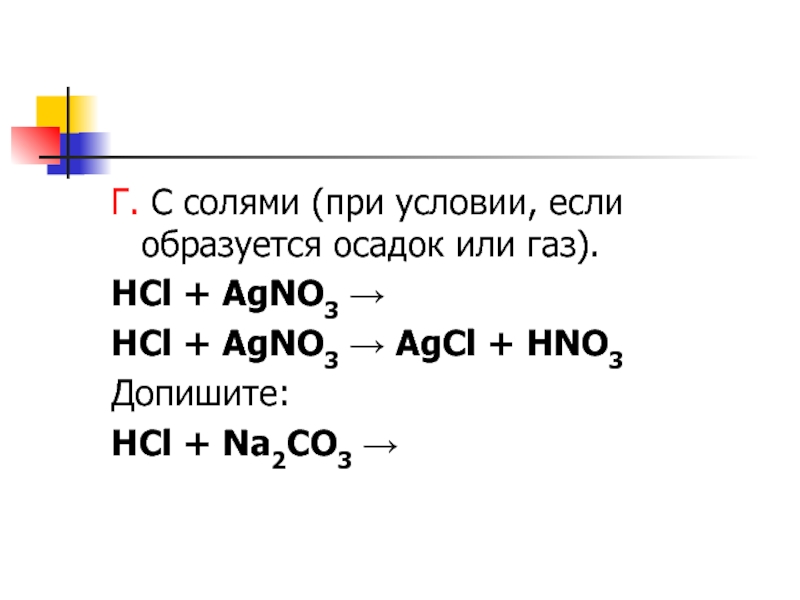
- 8. Г. С солями (при условии, если образуется
- 9. 2. Восстановительные свойства.4HCl + MnO2 → MnCl2
- 10. Работа на уроке:Решим задачу №6 на стр.145Соли
- 11. Скачать презентанцию
Хлороводород HClHCl – это бесцветный газ с резким неприятным запахом, тяжелее воздуха.Докажем это:М (HCl)= 1+35,5=36,5 г/мольМ (воздуха)= 29 г/моль
Слайды и текст этой презентации
Слайд 3Получение HCl
В лаборатории:
t
NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl
В промышленности:
H2 + Cl2 → 2HCl
свет
CH4 + Cl2 → CH3Cl+ HCl
Слайд 4Соляная кислота HCl
Соляная кислота сильная, т.е. в водных растворах полностью
распадается на ионы:
HCl → H+ + Cl-Растворы кислоты не имеют запаха.
Слайд 5Химические свойства
Кислотные свойства
А. Взаимодействие с металлами, стоящими в ряду активности
до водорода:
HCl + Zn →
2HCl + Zn → ZnCl2
+ H2Допишите:
HCl + Al →
Слайд 8
Г. С солями (при условии, если образуется осадок или газ).
HCl
+ AgNO3 →
HCl + AgNO3 → AgCl + HNO3
Допишите:
HCl
+ Na2CO3 →Слайд 9
2. Восстановительные свойства.
4HCl + MnO2 → MnCl2 + Cl2 +
2H2O
16HCl + 2KMnO4 → 2MnCl2 + 5Cl2 +
+ 2KCl + 8H2O6HCl + KClO3 → 3Cl2 + KCl + 3H2O
Слайд 10Работа на уроке:
Решим задачу №6 на стр.145
Соли соляной кислоты §
30
Применение соляной кислоты § 30
Фтор, бром, иод, их соединения §
31Д/З § 29 ? 4,
§ 30 ? 7,
§ 31 ? 13.
Prezentacii.com
Теги