Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Скорость химической реакции. Факторы влияющие на скорость химических реакций
Содержание
- 1. Скорость химической реакции. Факторы влияющие на скорость химических реакций
- 2. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИИ ПО ПРИЗНАКУ ФАЗНОСТИ
- 3. СКОРОСТИ РЕАКЦИЙСкорость гомогенной
- 4. Факторы влияющие на скорость химической реакцииКонцентрация А+B=C+D V=k[A]*[B]Природа реагирующих веществПлощадь поверхности соприкосновениятемпературакатализатор
- 5. Задача 1Решения задач В некоторый момент времени
- 6. Задача 2Решения задач Как изменится скорость, протекающей
- 7. Задача 3Решения задач Как изменится скорость реакции
- 8. Задача 4Решения задач При повышении температуры на
- 9. Тест: закрепление знаний1. Для уменьшения скорости реакции
- 10. Тест: закрепление знаний6. Укажите, как изменится скорость
- 11. Скачать презентанцию
Слайды и текст этой презентации
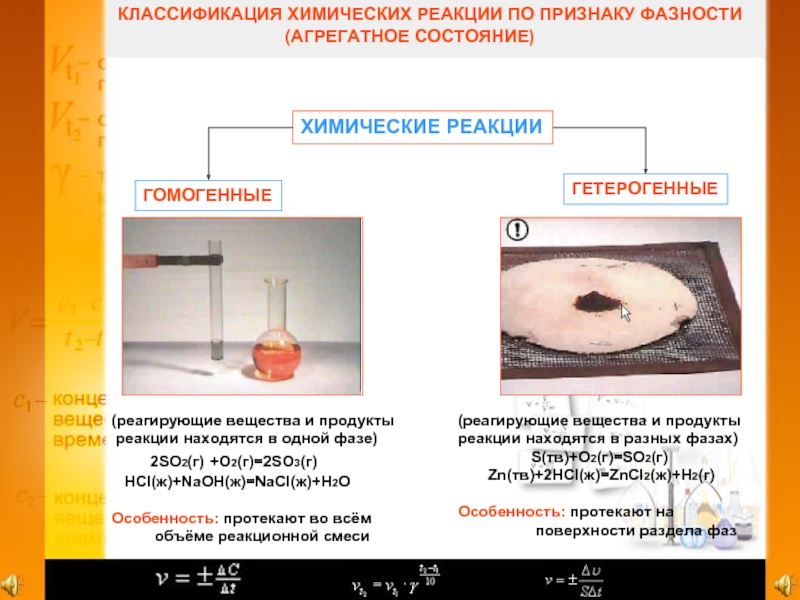
Слайд 2КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИИ ПО ПРИЗНАКУ ФАЗНОСТИ
(АГРЕГАТНОЕ СОСТОЯНИЕ)
ХИМИЧЕСКИЕ РЕАКЦИИ
ГОМОГЕННЫЕ
ГЕТЕРОГЕННЫЕ
(реагирующие вещества и продукты
реакции находятся в одной фазе)
2SO2(г) +O2(г)=2SO3(г)
HCl(ж)+NaOH(ж)=NaCl(ж)+H2O
Особенность: протекают во всём
объёме реакционной смеси
(реагирующие вещества и продукты
реакции находятся в разных фазах)
S(тв)+O2(г)=SO2(г)
Zn(тв)+2HCl(ж)=ZnCl2(ж)+H2(г)
Особенность: протекают на
поверхности раздела фаз
Слайд 3СКОРОСТИ РЕАКЦИЙ
Скорость гомогенной
реакции
Скорость гетерогенной
реакции
А (г) +В (г) =
С (г)∆V = V2-V1
∆ t = t2-t1
V (гом) = ∆V /(∆ t * V)
С = V / V (моль/л)
V (гом) = ± ∆С/ ∆ t (моль/л*с)
V (гет) = ± ∆V /(S*∆ t ) (моль/м^2*с)
Слайд 4Факторы влияющие на скорость химической реакции
Концентрация
А+B=C+D
V=k[A]*[B]
Природа
реагирующих
веществ
Площадь
поверхности
соприкосновения
температура
катализатор
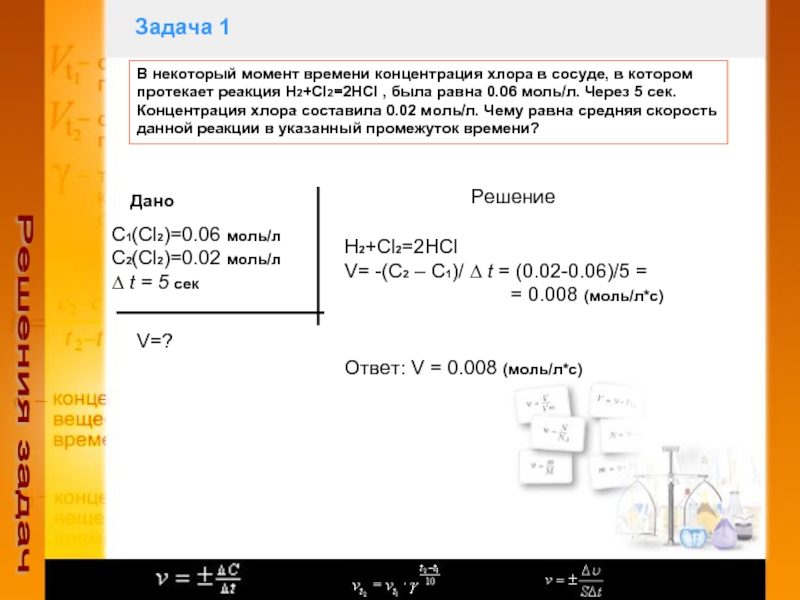
Слайд 5Задача 1
Решения задач
В некоторый момент времени концентрация хлора в
сосуде, в котором протекает реакция H2+Cl2=2HCl , была равна 0.06
моль/л. Через 5 сек. Концентрация хлора составила 0.02 моль/л. Чему равна средняя скорость данной реакции в указанный промежуток времени?Дано
С1(Cl2)=0.06 моль/л
С2(Сl2)=0.02 моль/л
∆ t = 5 сек
V=?
Решение
H2+Cl2=2HCl
V= -(C2 – C1)/ ∆ t = (0.02-0.06)/5 =
= 0.008 (моль/л*с)
Ответ: V = 0.008 (моль/л*с)
Слайд 6Задача 2
Решения задач
Как изменится скорость, протекающей в водном растворе,
реакции
FeCl3+3KCNS=Fe(CNS)3+3KCl при разбавлении реагирующей смеси водой
в два раза
Дано
С(ионов)
2 разаV2/V1=?
Решение
Fe(3+) + 3CNS(-) = Fe(CNS)3
V =k[Fe(3+)]*[CNS(-)]^3
пусть до разбавления: х = [Fe(3+)]
Y = [CNS(-)]^3
В результате разбавления концентрация ионов
уменьшается:
x/2 = [Fe(3+)] y/2 = [CNS(-)]
V2/V1 = k*(x/2)*(y/2)^3 = 16
Ответ: V2/V1 = 16
^3 – в степени 3
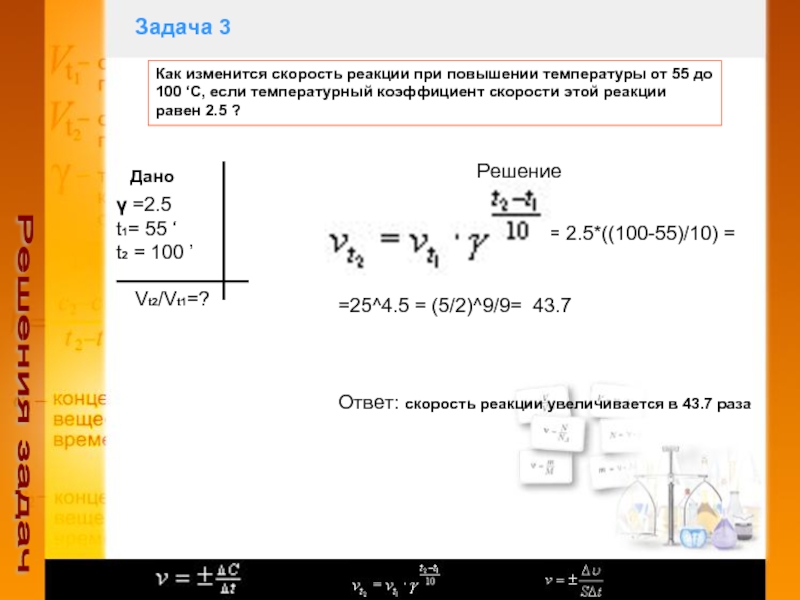
Слайд 7Задача 3
Решения задач
Как изменится скорость реакции при повышении температуры
от 55 до 100 ‘С, если температурный коэффициент скорости этой
реакции равен 2.5 ?Дано
γ =2.5
t1= 55 ‘
t2 = 100 ’
Vt2/Vt1=?
Решение
= 2.5*((100-55)/10) =
=25^4.5 = (5/2)^9/9= 43.7
Ответ: скорость реакции увеличивается в 43.7 раза
Слайд 8Задача 4
Решения задач
При повышении температуры на 30 ‘С, скорость
некоторой реакции
увеличивается в 64 раза. Чему равен температурный коэффициент
скорости этой реакции? Дано
Vt2/Vt1=64
t2 = 30 ’
γ =?
Решение
= γ^3
64 = γ^3 γ = 4
Ответ: температурный коэффициент скорости
реакции равен 4.
Слайд 9Тест: закрепление знаний
1. Для уменьшения скорости реакции необходимо:
а) увеличить концентрацию
реагирующих веществ
б) ввести в систему катализатор
в) повысить температуру
г) понизить температуру
2.
С наибольшей скоростью протекает реакция:а) нейтрализации
б) горение серы в воздухе
в) растворение магния в кислоте
г) восстановление оксида меди водородом
3. Укажите гомогенную реакцию.
а) CaO+H2O=Ca(OH)2
б) S+O2=SO2
в) 2CO+O2=2CO2
г) MgCO3→MgO+CO2
4. Укажите гетерогенную реакцию.
а) 2CO+O2=2CO2
б) H2+Cl2=2HCl
в) 2SO2+O2=2SO2 (кат V2O5)
г) N2O+H2=N2+H2O
5. Отметьте, какая реакция является одновременно
гомогенной и каталитической.
а) 2SO2+O2=2SO3 (кат NO2)
б) CaO+CO2=CaCO3
в) H2+Cl2=2HCl
г) N2+3H2=2NH3 (кат Fe)
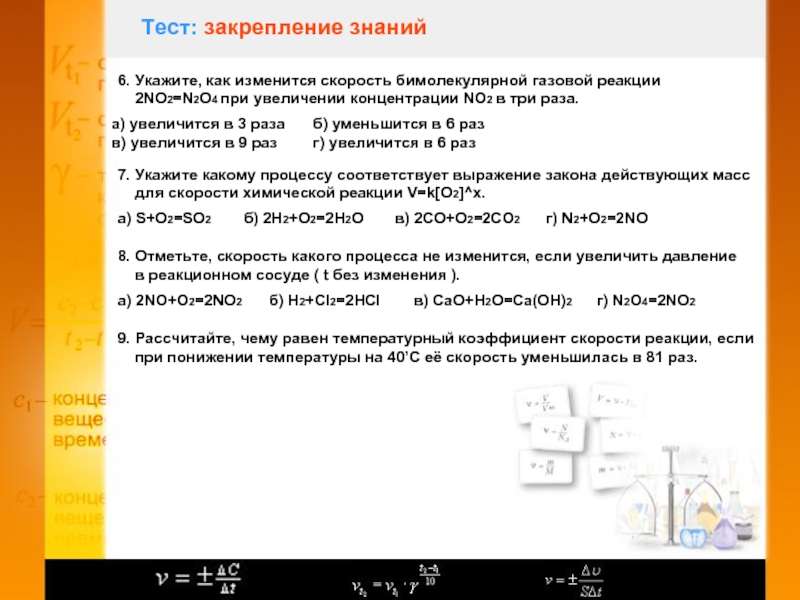
Слайд 10Тест: закрепление знаний
6. Укажите, как изменится скорость бимолекулярной газовой реакции
2NO2=N2O4 при увеличении концентрации NO2 в три раза.
а) увеличится
в 3 разаб) уменьшится в 6 раз
в) увеличится в 9 раз
г) увеличится в 6 раз
7. Укажите какому процессу соответствует выражение закона действующих масс
для скорости химической реакции V=k[O2]^x.
а) S+O2=SO2
б) 2H2+O2=2H2O
в) 2CO+O2=2CO2
г) N2+O2=2NO
8. Отметьте, скорость какого процесса не изменится, если увеличить давление
в реакционном сосуде ( t без изменения ).
а) 2NO+O2=2NO2
б) H2+Cl2=2HCl
в) CaO+H2O=Ca(OH)2
г) N2O4=2NO2
9. Рассчитайте, чему равен температурный коэффициент скорости реакции, если
при понижении температуры на 40’С её скорость уменьшилась в 81 раз.


![Скорость химической реакции. Факторы влияющие на скорость химических реакций Факторы влияющие на скорость химической реакцииКонцентрация А+B=C+D V=k[A]*[B]Природа реагирующих веществПлощадь поверхности соприкосновениятемпературакатализатор Факторы влияющие на скорость химической реакцииКонцентрация А+B=C+D V=k[A]*[B]Природа реагирующих веществПлощадь поверхности соприкосновениятемпературакатализатор](/img/thumbs/002f0ab35b40ba818d1376ea3172a02f-800x.jpg)