Слайд 1Учебно-исследовательская работа по химии на тему:
«Истинные растворы».
Выполнила: ученица 11
класса
Евстратова Ксения Александровна
1771133 Тверская область
Вышневолоцкий район
село Есеновичи
площадь Правды
д.21 кв.14
Руководитель: учитель химии
Тухта Валентина Анатольевна
МОУ «Есеновичская СОШ»
2009 год
Слайд 2Оглавление
Введение
3
слайд
Основная часть 4-9 слайд
Вывод 10 слайд
Список используемой литературы 11 слайд
Слайд 3Введение
Цель: Исследовать и изучить свойства истинных растворов.
Для достижения поставленной
цели мы выявили следующие задачи:
Выяснить какие растворы называются истинными;
❷Определить движущие
силы образования растворов;
❸Выяснить особенность истинных растворов;
❹Определить размеры истинных растворов на примере хлорида натрия;
❺Определить принцип разложения истинных растворов.
Слайд 4Основная часть
1. Раствор – гомогенная (однородная) система,
состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
Растворы все однофазны, то есть представляют собой однородный газ, жидкость или твердое вещество. Это связано с тем, что одно из веществ распределено в массе другого в виде молекул, атомов и ионов.
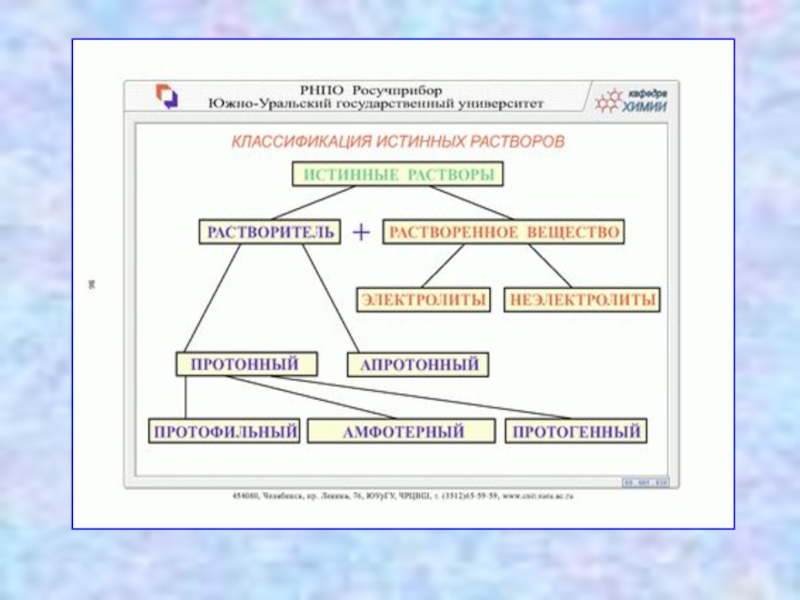
Когда вещество находится в окружающей среде в виде молекул или ионов, то такие растворы называют истинными, т.е. гомогенными однофазными растворами.
В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Слайд 6
2. Движущими силами образования растворов являются энтропийный и энтальпийный факторы.
При растворении газов в жидкости энтропия всегда уменьшается ΔS
при растворении кристаллов возрастает (ΔS > 0). Чем сильнее взаимодействие растворенного вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов. Знак изменения энтальпии растворения определяется знаком суммы всех тепловых эффектов процессов, сопровождающих растворение, из которых основной вклад вносят разрушение кристаллической решетки на свободные ионы (ΔH > 0) и взаимодействие образовавшихся ионов с молекулами растворителя (сольтивация, ΔH < 0). При этом независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ нет) всегда ΔG = ΔH – T·ΔS < 0, т. к. переход вещества в раствор сопровождается значительным возрастанием энтропии вследствие стремления системы к разупорядочиванию. Для жидких растворов (расплавов) процесс растворения идет самопроизвольно (ΔG < 0) до установления динамического равновесия между раствором и твердой фазой.
Слайд 7
3. Истинные растворы бывают ионно-дисперсными и
молекулярно-дисперсными. Размер частиц в первых составляет менее 1 нм, а
растворенное вещество находится в виде отдельных гидратированных ионов и молекул в равновесных количествах. Истинные растворы всегда прозрачны, они не должны содержать взвешенных частиц и осадка. Особенностью истинных растворов является то, что они гомогенны даже при рассматривании в электронный микроскоп. Компоненты, входящие в их состав, не могут быть разделены никаким способом. Истинные растворы хорошо диффундируют. К этой группе относятся растворы электролитов и неэлектролитов, таких как глюкоза, натрия хлорид, спирт, магния сульфат и т.д.
Слайд 8
4. Рассмотрим размеры истинных веществ на примере
хлорида натрия. Кристаллы любого вещества, например хлорид натрия, можно получить
разного размера – крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещества внутреннюю структуру – молекулярную или ионную кристаллическую решетку.
При растворении в воде кристаллов хлорида натрия образуются соответственно молекулярные и ионные растворы. Таким образом, одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2 мм, разрешающая способность глаза), микроскопически видимые частицы (от 0,2-0,1мм до 400-300нм, разрешающая способность микроскопа при освещении белым светом) и в молекулярном (или ионном) состоянии.
Хлорид натрия
Слайд 95. Истинными называются растворы, в которых растворенное вещество находится в
ионной форме.
Причиной разложения в воде молекул вещества
на ионы является электролитическая диссоциация электролитов. Процесс электролитической диссоциации, например, соляной и угольной кислот можно выразить формулами:
НСl —› Н+ + Сl-
Н2СO3 —› Н+ + НСO3-;
НСO3- —› Н+ + СO32-;
В ионном растворе соблюдается принцип электронейтральности, поэтому в нем всегда находится равное число эквивалентов катионов и анионов. Катионы имеют положительный заряд и названы так потому, что при электролизе движутся к катоду. Анионы же имеют отрицательный заряд и при электролизе движутся к аноду.
Слайд 10Вывод
✵Проведя исследования, я пришла к следующим выводам:
1. Растворы называют
истинными, когда вещество находится в окружающей среде в виде молекул
или ионов.
2. Движущими силами образования растворов являются энтропийный и энтальпийный факторы.
3. Особенностью истинных растворов является то, что они гомогенны даже при рассматривании в электронный микроскоп. Компоненты, входящие в их состав, не могут быть разделены никаким способом. Истинные растворы хорошо диффундируют.
4. Одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2 мм, разрешающая способность глаза), микроскопически видимые частицы (от 0,2-0,1мм до 400-300нм, разрешающая способность микроскопа при освещении белым светом) и в молекулярном (или ионном) состоянии.
5. В ионном растворе соблюдается принцип электронейтральности, поэтому в нем всегда находится равное число эквивалентов катионов и анионов.
Слайд 11Список используемой литературы
1.Химия. 11 класс : Учеб. Для общеобразоват.учреждений/ О.С.
Габриелян, Г.Г. Лысова. – 2-е изд., испр.- М.: Дрофа, 2002.
2.www.krugosvet.ru/articles/43/1004374/1004374a1.htm
· 24 КБ
3.www.college.ru/chemistry/course/content/chapter6/section/paragraph1/theory.h.. · 14 КБ