Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислород и водород
Содержание
- 1. Кислород и водород
- 2. повторить физические и химические свойства водорода и
- 3. Примерно века два назад открыт он был
- 4. Я газ, легчайший и бесцветный, неядовитый и
- 5. Работа по вариантам 1- вариант пишет про
- 6. 1.Газ без цвета и вкуса.2. Газ имеет
- 7. Вариант1 – кислород – 1, 5, 6,
- 8. ВодородКислород1) в космосе-92% 1) в воздухе-21%2) в
- 9. Правильные ответы
- 10. Известно, что горят отлично в нём сера,
- 11. - Как называются соединения элементов с кислородом?-Дайте
- 12. Н2+CuO→ Н2О→Н2 → НСl → FeCl2 +
- 13. В промышленности – конверсией водяных паров с
- 14. В лаборатории:1) действием разбавленных кислот (кроме HNO3)
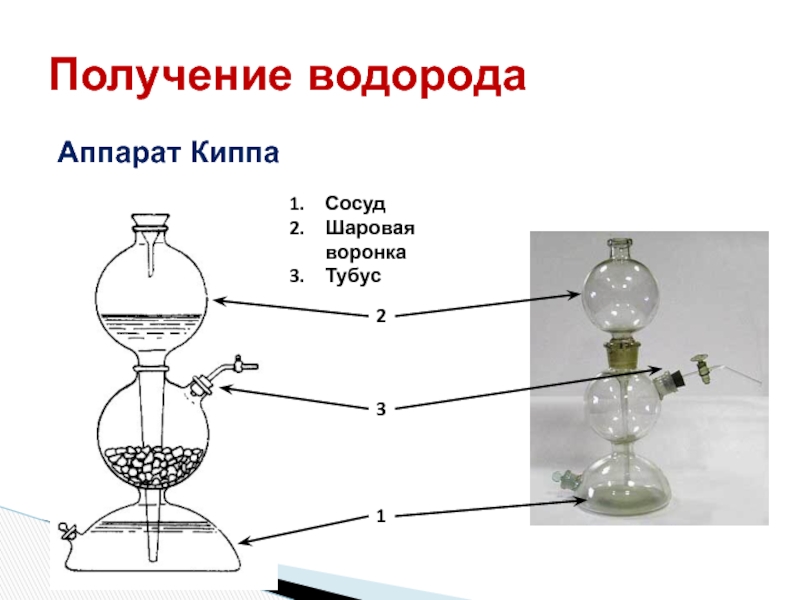
- 15. Получение водородаАппарат КиппаСосудШаровая воронкаТубус 123
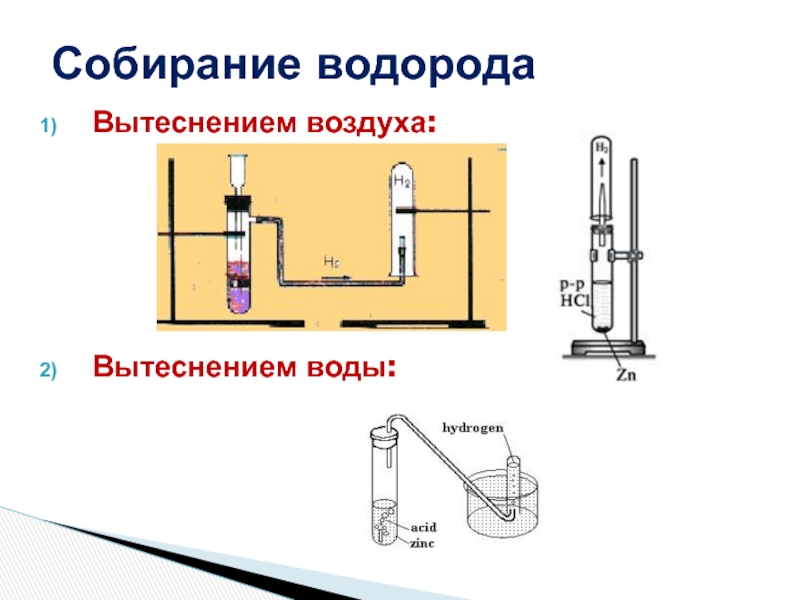
- 16. Собирание водородаВытеснением воздуха:Вытеснением воды:
- 17. Применение1) Химическая промышленность: получение аммиака, метанола, мыла, пластмасс и др.
- 18. Применение2) Пищевая промышленность: а) производство маргарина б) пищевая добавка Е949 (упаковочный газ)
- 19. Применение3) Топливо (ракетное, машинное)
- 20. Применение4) Военная промышленность (производство водородных бомб)
- 21. Применение5) Резка и сварка металловПламенем водородной горелкиможно резать и сваривать металлы
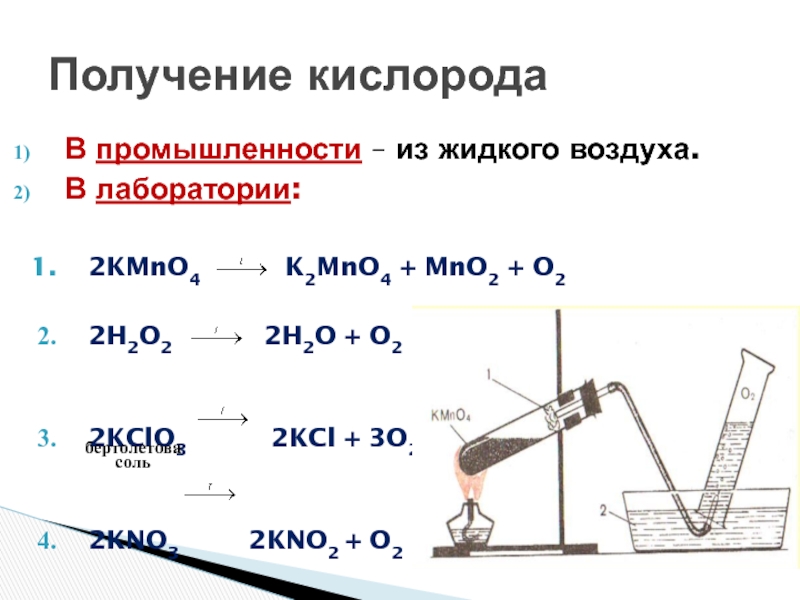
- 22. Получение кислородаВ промышленности – из жидкого воздуха.В
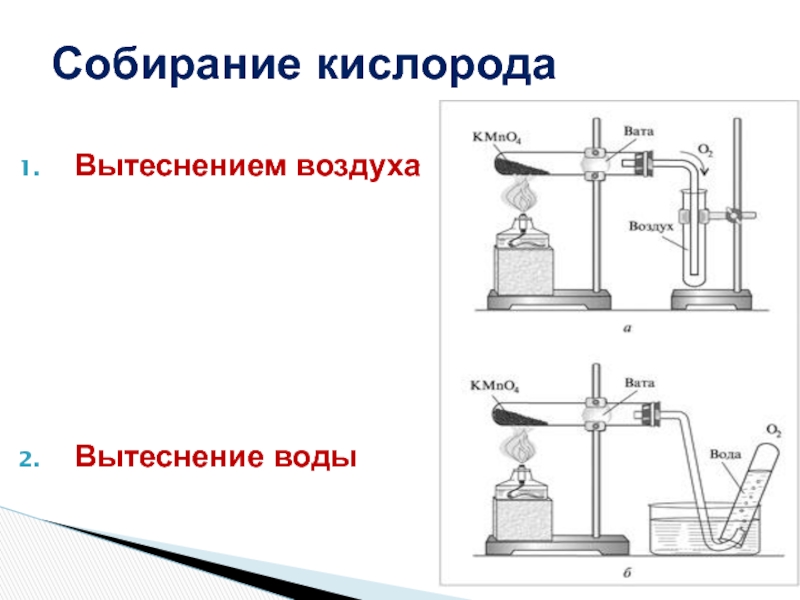
- 23. Вытеснением воздухаВытеснение водыСобирание кислорода
- 24. Применение кислорода1. Металлургия: производство стали, сжигание топлива и др.
- 25. Применение кислорода2. Сварка и резка металлов
- 26. Применение кислорода3. Ракетное топливоВ качестве окислителя для
- 27. Применение кислорода4. МедицинаКислород используется для обогащения дыхательных
- 28. Применение кислорода5. Пищевая промышленностьВ пищевой промышленности кислород
- 29. На каком рисунке (а или б) отображен
- 30. Водород является продуктом взаимодействия:1) Cu + HCl;
- 31. Водород не реагирует с:1) N2; 2) S; 3) O2; 4) HCl
- 32. Водород реагирует:1) только с простыми веществами; 2)
- 33. Водород реагирует с:1) Н2О; 2) SO3; 3) Cl2; 4) Au
- 34. 1) Сколько литров кислорода потребуется для окисления
- 35. Решить цепочку превращений:H2→MgH2 → H2 → X1 → H2 → X2 → H2+CuOэл.ток+ C
- 36. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2повторить физические и химические свойства водорода и кислорода, распространение их
в природе
вспомнить уравнения горения простых и сложных веществ
познакомиться со способами
получения газов в лаборатории и промышленностирассмотреть способы собирания и распознавания водорода и кислорода
узнать области применения этих газов
Цели урока
Слайд 3Примерно века два назад открыт он был случайно.
Сейчас знаком с
ним стар и млад
и он для нас не тайна.
Без
газа этого на свете не жили б звери и народ.Его б узнать могли бы дети,
ведь это-…..
-Как вы догадались, что это ……?
-Почему его так назвали?
-Кем и когда был открыт?
Угадайте, о каком газе идёт речь в стихотворении:
Слайд 4Я газ, легчайший и бесцветный, неядовитый и безвредный.
Соединяясь с кислородом,
я для питья даю вам воду.
-Какие физические свойства газа описаны
здесь?-Почему этот газ носит такое название?
-Когда и кто его открыл?
Угадайте, о каком газе идёт речь в стихотворении:
Слайд 5Работа по вариантам
1- вариант пишет про кислород
2- про водород
Если
ребята согласны с утверждением, то ставится знак «+», если не
согласны, то знак «-».Кодовый диктант
(сравнение физических свойств газов)
Слайд 61.Газ без цвета и вкуса.
2. Газ имеет неприятный запах.
3.Газ легче
воздуха.
4.Обладает самой высокой электропроводностью.
5.Малорастворимый газ в воде.
6.Этот газ хорошо поддерживает
горение.8.Выделяется в процессе фотосинтеза.
Вопросы
Слайд 8Водород
Кислород
1) в космосе-92%
1) в воздухе-21%
2) в земной коре-1%
2) в
земной коре-92%
3) в виде соединений на земле
3) в гидросфере-89%
4) в
атмосфере-0,0005%4) в живых организмах-65%.
Рассказать о нахождении газов в природе пользуясь данными
Слайд 10Известно, что горят отлично в нём сера, фосфор, углерод,
Железо, магний,
энергично сгорает даже водород.
Запишите уравнения реакций, о которых говорится в
стихотворении: Слайд 11- Как называются соединения элементов с кислородом?
-Дайте определение реакциям горения.
-
Каков тепловой эффект реакций горения?
- Где используются реакции горения метана
и ацетилена?А как горят сложные вещества? Написать уравнения горения метана (СН4) и ацетилена (С2Н2)
Слайд 12Н2+CuO→ Н2О→Н2 → НСl → FeCl2 + …
- Какая
реакция отражает восстановление металлов из их оксидов?
- Какие свойства при
этом проявляет водород?Осуществите цепочку превращений:
Слайд 13В промышленности – конверсией водяных паров с углем или метаном:
С
+ H2O = CO + H2
CH4 + H2O = CO
+ 3H2Получение водорода
Слайд 14В лаборатории:
1) действием разбавленных кислот (кроме HNO3) на металлы:
Zn + 2HCl = ZnCI2 +H2
2) взаимодействием
кальция с водой:Ca + 2H2O = Ca(OH)2 + H2
3) разложением гидридов водой:
NaH + H2O = NaOH + H2
5) электролизом воды:
2H2O = 2H2 + O2
Получение водорода
Слайд 18Применение
2) Пищевая промышленность:
а) производство маргарина
б) пищевая добавка Е949 (упаковочный газ)
Слайд 21Применение
5) Резка и сварка металлов
Пламенем водородной горелки
можно резать и сваривать
металлы
Слайд 22Получение кислорода
В промышленности – из жидкого воздуха.
В лаборатории:
2KMnO4
K2MnO4 + MnO2 + O2
2H2O2
2H2O + O22KClO3 2KCl + 3O2
2KNO3 2KNO2 + O2
бертолетова
соль