Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислоты
Содержание
- 1. Кислоты
- 2. Сложные вещества, состоящие из кислотных остатков и водорода, который может замещаться на атомы металлов.Кислоты-
- 3. Mg+2HCl→MgCl₂+H₂↑Соляная
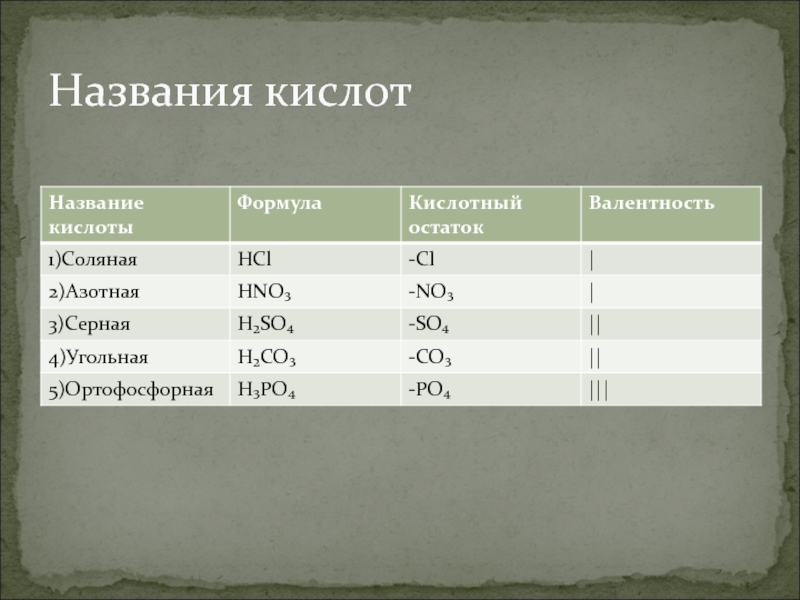
- 4. Названия кислот
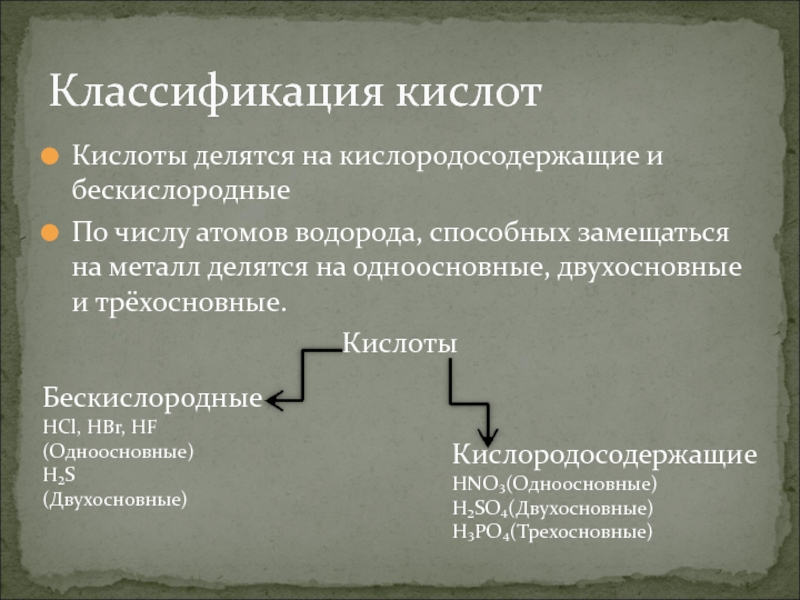
- 5. Кислоты делятся на кислородосодержащие и бескислородныеПо числу
- 6. H OH OH OH OСтруктурные формулы кислотP=O –Ортофосфорная кислотаH OSOO-Серная кислота
- 7. 1)Почти все кислоты растворимы в воде(кроме H₂SiO₃)2)Могут
- 8. Действие кислот на растворы индикаторов:1)Растворы кислот окрашивают
- 9. С чем реагируют(хим.св.)
- 10. Скачать презентанцию
Сложные вещества, состоящие из кислотных остатков и водорода, который может замещаться на атомы металлов.Кислоты-
Слайды и текст этой презентации
Слайд 2 Сложные вещества, состоящие из кислотных остатков и водорода,
который может замещаться на атомы металлов.
Слайд 3Mg+2HCl→MgCl₂+H₂↑
Соляная Хлорид
кислота
магния
Mg+H₂SO₄→MgSO₄+H₂↑
Серная Сульфиткислота магния
2Al+6HCl→2AlCl₃+3H₂
Соляная Хлорид
кислота алюминия
1)Кислотные остатки в химических реакциях обычно сохраняют и переходят из одних соединений в другие.
2)Валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металлов.
Состав кислот
Слайд 5Кислоты делятся на кислородосодержащие и бескислородные
По числу атомов водорода, способных
замещаться на металл делятся на одноосновные, двухосновные и трёхосновные.
Кислоты
Классификация кислот
Бескислородные
HCl,
HBr, HF (Одноосновные)H₂S
(Двухосновные)
Кислородосодержащие
HNO₃(Одноосновные)
H₂SO₄(Двухосновные)
H₃PO₄(Трехосновные)
Слайд 71)Почти все кислоты растворимы в воде(кроме H₂SiO₃)
2)Могут быть газообразными, жидкими,
твердыми
3)Некоторые кислоты имеют запах и цвет
Физические свойства
Слайд 8Действие кислот на растворы индикаторов:
1)Растворы кислот окрашивают лакмус в красный,
метиловый - оранжевый в розовый, фенолфталеин остаётся бесцветным
2)Характерным свойством кислот
является их взаимодействие с металлами. При выпаривании образовавшихся растворов выделяются кристаллические вещества – соли.K, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb –вытесняют водород из кислот
Cu, Hg, Ag, Pt, Au – водород из кислот не вытесняют
Химические свойства