Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Получение кристаллов солей из насыщенных растворов
Содержание
- 1. Получение кристаллов солей из насыщенных растворов
- 2. Актуальность:Кристаллы всегда интересовали умы человека.Как они получаются
- 3. Цель нашей работы: изучение
- 4. Методы исследования:Накопление теоретического материала;Проведение опытно-экспериментальной деятельности с целью получения кристаллов из раствора;Анализ полученных результатов исследования
- 5. Обьектом исследования являются кристаллыПредметом исследования - процесс кристаллизации
- 6. Гипотеза: мы предположили, что кристаллы могут появляться
- 7. Получение кристаллов солей
- 8. Приготовление маточного раствора:Растворила соли в горячей
- 9. ВЫРАЩИВАНИЕ ЗАТРАВКИ:Через сутки на дне стакана образовались
- 10. Выращивание кристаллов: Приготовила новый насыщенный растворПривязала кристалл-затравку
- 11. Слайд 11
- 12. Получение кристаллов солей из насыщенных растворов изотермической
- 13. Кристаллы поваренной соли (NaCl)Бесцветные кристаллы поваренной
- 14. Кристаллы дихромата калия имеют форму ромба или вытянутых призм с ярко оранжевой окраской
- 15. Кристаллы хромата калия имеют форму параллелепипедов с желтой окраской
- 16. Кристаллы перманганата калия (обычной марганцовки) имеют игольчатую форму ярко-фиолетового цвета
- 17. Влияние примесей на форму кристалла Мы исследовали
- 18. Выводы: В ходе проведенной работы выполнили
- 19. Заключение Мы выращивали кристаллы двумя разными
- 20. Применяя изотермический метод можно изучать форму кристаллов
- 21. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1
“Получение
кристаллов солей
из насыщенных растворов»
Выполнила:
ученица 11-го класса
МБОУ
Майорской СОШ
Слайд 2Актуальность:
Кристаллы всегда интересовали умы человека.
Как они получаются в природе, как
вырастают, может ли человек сам управлять ростом кристаллов? Поэтому нам
стало интересно, сможем ли мы сами вырастить такой кристалл из раствора.Так для любых теоретических данных необходимо практическое подтверждение, то для нас стало актуально подтвердить на практике полученные нами теоретические сведения о процессе выращивания кристаллов
Слайд 3 Цель нашей работы: изучение методики получения кристаллов
из растворов и их исследование в лабораторных условиях
Задачи:
изучить литературу по данной теме;
апробировать опытно-экспериментальным путем способы получения кристаллов из растворов;
исследовать форму полученных кристаллов;
исследовать влияние примесей на форму кристаллов
Слайд 4Методы исследования:
Накопление теоретического материала;
Проведение опытно-экспериментальной деятельности с целью получения кристаллов
из раствора;
Анализ полученных результатов исследования
Слайд 6Гипотеза: мы предположили, что кристаллы могут появляться при использовании разных
способов выращивания и при создании определенных для них условий. Значит,
если изменить условия кристаллизации, то можно получить кристаллы разной формыПрактическое значение исследования:
состоит в том, что оно может быть использовано на уроках окружающего мира, во внеклассных мероприятиях,занятиях кружка “Юный химик”
Новизна исследования: заключается в представлении выработанных рекомендаций юным исследователям по выращиванию кристаллов которые способствуют повышению интереса активности и самостоятельности в опытно-экспериментальной деятельности, а также познания мира младшими школьниками.
Слайд 7 Получение кристаллов солей из насыщенных растворов изогидрической кристаллизацией
(за счет изменения температуры раствора)
Растворимость большинства веществ уменьшается с понижением
температуры. Поэтому при охлаждении горячих растворов возникает пересыщение, обусловливающее выделение кристаллов. Количество растворителя (например, воды) при этом остается постоянным.
Изучив растворимость различных солей в 100 граммах воды при различной температуре мы выбрали следующие соли
Слайд 8Приготовление
маточного раствора:
Растворила соли в горячей воде , пока не
получила насыщенный раствор
Насыщенный раствор профильтровала. Оставила раствор медленно остывать.
Слайд 9ВЫРАЩИВАНИЕ ЗАТРАВКИ:
Через сутки на дне стакана образовались кристаллы соли
Раствор слила,
кристаллы осторожно отделила друг от друга,выбрала из них самый крупный
и правильныйСлайд 10Выращивание кристаллов:
Приготовила новый насыщенный раствор
Привязала кристалл-затравку на нитку,закрепила на стеклянной
палочке,опустила кристалл в раствор. Наблюдала за ростом кристалла несколько недель
Слайд 12Получение кристаллов солей из насыщенных растворов
изотермической кристаллизацией
(методом выпаривания)
Этим методом
нами были получены и исследованы с помощью школьного микроскопа кристаллы
поваренной соли NaCl, дихромата калия К2Сr2O7, хромата калия К2СrO4 и перманганата калия КMnO4Для приготовления препарата кристаллов использовали следующую методику:
1) Готовим в химическом стаканчике при нагревании насыщенный раствор исследуемой соли;
2) Тщательно очищаем предметное стекло от пыли и отпечатков пальцев;
3) Наносим на предметное стекло пипеткой раствор соли и немного нагреваем в пламени спиртовки до появления первых кристаллов
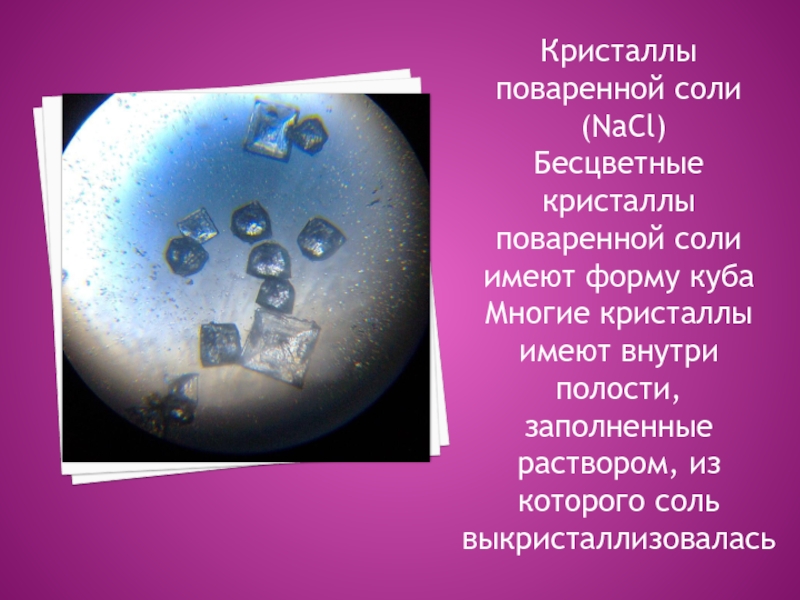
Слайд 13
Кристаллы поваренной соли
(NaCl)
Бесцветные кристаллы поваренной соли имеют форму куба
Многие кристаллы имеют внутри полости, заполненные раствором, из которого соль
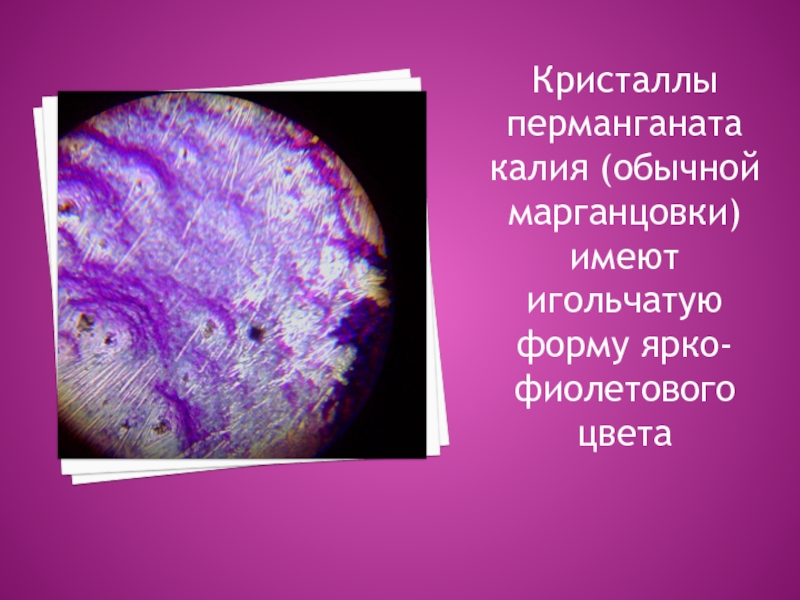
выкристаллизовалась Слайд 16Кристаллы перманганата калия (обычной марганцовки) имеют игольчатую форму ярко-фиолетового цвета
Слайд 17Влияние примесей на форму кристалла
Мы исследовали форму кристаллов поваренной соли,
содержащей примеси глюкозы.
Смешали раствор хлорида натрия с небольшим
количеством глюкозы (С6Н12О6) и рассмотрели его под микроскопом. Кристаллов с кубической формой почти не осталось, но зато выпали кристаллы в форме пирамид. Слайд 18Выводы:
В ходе проведенной работы выполнили следующие задачи:
Изучили
литературу по данной теме;
Апробировали опытно-экспериментальным путем способы получения кристаллов из
растворов;Исследовали форму полученных кристаллов;
Исследовали влияние примесей на форму кристаллов
Слайд 19Заключение Мы выращивали кристаллы двумя разными методами: изогидрической кристаллизацией (за
счет изменения температуры раствора) и изотермической кристаллизацией (методом выпаривания). Подготовка
к работе велась с начала учебного года, эксперимент начался 8 ноября и продолжался в течение 7-ми недель. Эксперименты показали, что при использовании изогидрической кристаллизации: если процесс идёт очень медленно получается один большой кристалл – монокристалл, если быстро – то множество мелких – друзаМонокристаллы
Друза
Слайд 20 Применяя изотермический метод можно изучать форму кристаллов с помощью микроскопа.
Изучили строение поваренной соли NaCl, дихромата калия К2Сr2O7, хромата
калия К2СrO4 и перманганата калия КMnO4.Исследовав кристаллы поваренной соли, содержащей примеси глюкозы мы убедились, что поваренная соль изменила форму из кубического кристалла, где все грани растут с одинаковой скоростью в пирамиду и доказали, что форма кристаллов зависит от того, в каких условиях эти кристаллы были получены.
Таким образом, основная цель работы достигнута, мы изучили методики получения кристаллов и исследовали их в лабораторных условиях.