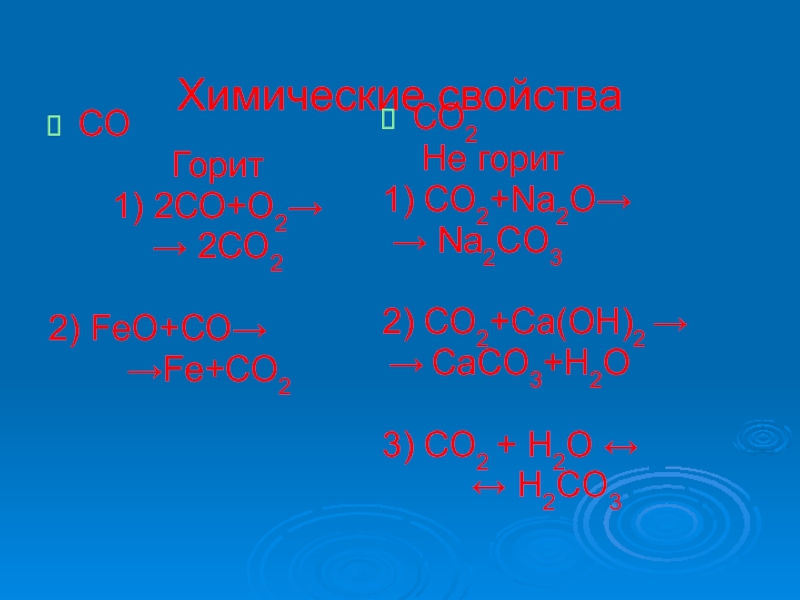Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислородные соединения углерода
Содержание
- 1. Кислородные соединения углерода
- 2. Угарный газ (СО)содержится в выхлопных газах автомобилей
- 3. Воздух, окутывающий Землю, содержит около 3 млрд. т. СО2
- 4. План изучения веществСостав качественный и количественныйТип связиФизические свойстваХимические свойстваПолучениеПрименение
- 5. Сравнительная характеристика СО и СО2
- 6. Качественный составСОУглерод и кислородСО2Углерод и кислород
- 7. Количественный составСО1 атом углерода и 1 атом кислородаСО2 1 атом углерода и 2 атома кислорода
- 8. Тип связиСОКовалентная полярнаяС≡ОСО2Ковалентная полярнаяО=С=О
- 9. Физические свойстваСОГазБез цвета, без запаха, без вкусаМалорастворим
- 10. Горение угарного газа
- 11. Химические свойстваСОГорит1) 2СО+О2→→ 2СО22) FeO+СО→
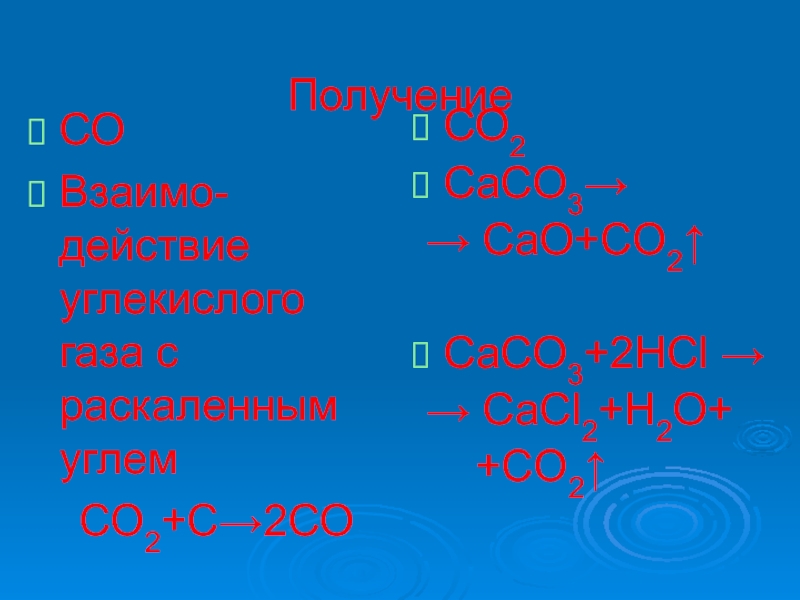
- 12. ПолучениеСОВзаимо-действие углекислого газа с раскаленным углем
- 13. ПрименениеСОВ качестве топливаСО2
- 14. «Сухой лед» для хранения мороженного
- 15. Для тушения пожаров
- 16. Создание «дыма» на сцене
- 17. Производство газированных напитков
- 18. Угольная кислота (Н2СО3 )Кислородосодержащая, нестойкая кислота, легко
- 19. Соли угольной кислотыКарбонаты( CaCO3, Na2CO3)Гидрокарбонаты(Ca(HCO3)2, NaHCO3)
- 20. Домашнее задание§29 задание №5 §29 задание №5, №6§29 задание №5,№6,№7
- 21. Скачать презентанцию
Угарный газ (СО)содержится в выхлопных газах автомобилей
Слайды и текст этой презентации
Слайд 4План изучения веществ
Состав качественный и количественный
Тип связи
Физические свойства
Химические свойства
Получение
Применение
Слайд 7Количественный состав
СО
1 атом углерода и 1 атом кислорода
СО2
1 атом
углерода и 2 атома кислорода
Слайд 9Физические свойства
СО
Газ
Без цвета,
без запаха,
без вкуса
Малорастворим в воде
Ядовит
СО2
Газ
Без цвета,
без запаха,
имеет слегка кисловатый вкус
Растворяется в воде
Слайд 11Химические свойства
СО
Горит
1) 2СО+О2→
→ 2СО2
2) FeO+СО→
→Fe+CO2
СО2
Не горит
1) СО2+Na2O→
→ Na2CO3
2) СО2+Ca(OH)2 →
→
CaCO3+H2O3) СО2 + H2O ↔
↔ H2CO3