Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Углеводороды и их природные источники 10 класс
Содержание
- 1. Углеводороды и их природные источники 10 класс
- 2. § 3. Природный газ. Алканы.§ 4. Алкены.
- 3. Природный газ. Алканы.
- 4. СН4 - метан 75-98%С2Н6 - этан 4%С3Н8
- 5. Алканы – это предельные углеводороды, в молекулах
- 6. гексадецилАлканы нормального строения
- 7. Номенклатура алканов1
- 8. Химические свойства алканов 1. Реакции замещенияГалогенированиепропан2-бромпропан (95%) 1-бромпропан (5%) Нитрованиеэтанразбавл.нитроэтан 2. Горение
- 9. Химические свойства алканов 3. Изомеризация бутанметилпропан 4. Реакции разложения КрекинггексадеканоктоноктанДегидрированиепропанпропен
- 10. Применение алкановСН4метанРезина;Картриджи;Типографская краска;Растворители;Хладагенты;Метанол;Ацетилен;
- 11. Алкены. Этилен.
- 12. Алкены – это непредельные углеводороды, содержащие в
- 13. Структурная изомерия алкенов 1. Изомерия углеродного скелета
- 14. Пространственная изомерия алкеновбутен-2 (цис-форма)бутен-2 (транс-форма)Плоскость π-связицис-изомертранс-изомер
- 15. Номенклатура алкеновэтен (этилен)пропен (пропилен)4
- 16. Получение алкенов1. В промышленности – дегидратацией предельных
- 17. Физические свойстваАлкены плохо растворимы в воде, но
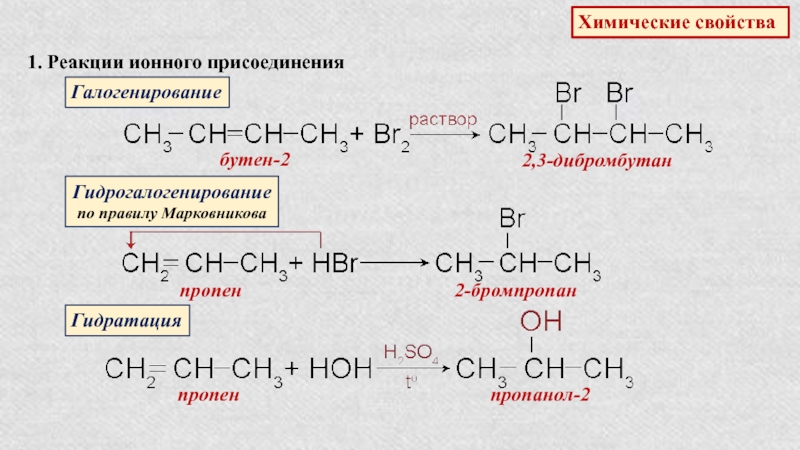
- 18. Химические свойства 1. Реакции ионного присоединенияГалогенированиебутен-22,3-дибромбутанГидрогалогенированиепо правилу Марковниковапропен2-бромпропанГидратацияпропенпропанол-2
- 19. Химические свойства 2. Реакции окисленияМягкое окислениеРеакция Вагнера3СН2=СН2+
- 20. Применение этиленаСтимулятор дозревания плодов;С2Н4этиленпроизводство полиэтилена;производство растворителей;производство уксусной кислоты;производство антифризов.
- 21. Алкадиены. Каучуки.
- 22. Алкадиены или диены – это непредельные углеводороды,
- 23. НоменклатураCH2=CH–CH2–СН=CH21 2
- 24. ИзомерияСтруктурная изомерия1. Изомерия углеродного скелета1
- 25. ИзомерияПространственная изомериягексадиен-1,3цис-гексадиен-1,3транс-гексадиен-1,3
- 26. Физические свойстваНизшие диены — бесцветные легкокипящие жидкости2,2-диметилбутадиен-1,368,78оСциклопентадиен-1,341,5оСизопрен34оСВысшие диены – твердые веществабутадиен-1,3 и пропадиен-1,3 – газы
- 27. Химические свойстваРеакции присоединения1,2-продукт1,4-продуктпродукт 1,2-присоeдинeнияпродукт 1,4-присоeдинeния
- 28. Реакции полимеризацииХимические свойствабутадиен-1,3 полибутадиен изопрен полиизопрен
- 29. КаучукПриродный каучукГевея (каучуковое дерево)цис-полиизопренотличается водо- и газонепроницаемостью;хороший
- 30. КаучукПриродный каучукИзопреновые остатки в каучуке связаны по принципу «голова к хвосту»:остаток изопрена
- 31. КаучукВулканизация каучукаПри нагревании каучука с серой (вулканизации)
- 32. КаучукВулканизация каучука В результате процесса вулканизации
- 33. Алкины. Ацетилен.
- 34. Алкины – это непредельные углеводороды, молекулы которых
- 35. НоменклатураПо номенклатуре ИЮПАК:4,6-диметил-4-этил-5-хлоргептин-27
- 36. Структурная изомерияИзомерия углеродного скелета (начиная с С5Н8):СН≡С‒СН2‒СН2‒СН3пентин-13-метилбутин-11
- 37. Физические свойства алкиновАлкины плохо растворимы в воде,
- 38. Получение алкинов1. Метановый способ:2. Карбидный способ:3. Дегидрогалогенирование:2,3-дибромбутанспиртовой раствор щелочибутин-2(диметилацетилен)
- 39. Химические свойства алкиновРеакции присоединения1. Галогенирование:CH3‒C≡CH+Br2→CH3‒CBr=CHBr1,2-дибромпропен-1CH3‒CBr=CHBr+Br2→CH3‒CBr2‒CHBr21,1,2,2-тетрабромпропан2. Гидратация (реакция Кучерова):этаноль (уксусный альдегид)
- 40. Химические свойства алкиновРеакции присоединения3. Гидрогалогенирование (правило Марковникова):пропин-12-бромпропен-12,2-дибромпропан
- 41. Химические свойства алкиновРеакции присоединения4. Гидрирование:5. Горение:коптящее пламя
- 42. Химические свойства алкиновРеакции полимеризации1. Димеризация под действием
- 43. Применение ацетиленаПоливинилхлоридАвтогенная сваркаСинтетический каучукСинтетическое волокноУксусная кислотаРастворители
- 44. Арены. Бензол.
- 45. Слайд 45
- 46. Слайд 46
- 47. Слайд 47
- 48. Химические свойства бензолаРеакции замещения1. Бромирование:бромбензол
- 49. Химические свойства бензолаРеакции замещения2. Нитрование:нитробензол3. Горение:
- 50. Слайд 50
- 51. Нефть и способы ее переработки
- 52. Физические свойства нефтигустая маслянистая горючая жидкость;цвет от
- 53. Химический состав нефтиУглеводороды(79-88%)Водород(11-14%)Сера(0,1-5%)Кислород, азоти др. элементы
- 54. Основные способы добычи нефтиФонтанный способГазлифтный способНасосный способДалее
- 55. НазадФонтанный способ добычи нефтиПодъем нефти на поверхность осуществляется за счет пластовой энергии.
- 56. НазадНефть из пласта поднимается на поверхность энергией газа, закачиваемого в скважину.Газлифтный способ добычи нефти
- 57. НазадПодъем нефти осуществляется спускаемыми в шахту насосами.
- 58. Способы переработки нефтиПерегонка (ректификация)Крекинг (разложение)РиформингДалее
- 59. Схема современной нефтеперегонной установкиПерегонка (ректификация)Назад
- 60. Крекинг (разложение)Крекинг - процесс расщепления углеводородов, содержащихся
- 61. Риформинг (ароматизация)Риформинг – переработка нефтепродуктов (главным образом
- 62. Фракции после перегонки сырой нефтиГазовая фракция.
- 63. Детонационная стойкость бензина Детонационная стойкость —
- 64. Продукты переработки нефти
- 65. Экологические проблемы использования нефтепродуктовЕжегодно в Мировой океан сбрасывается до 10 миллионов тонн нефти…
- 66. Список использованных материалов– О.С.Габриелян. Химия 10 класс.
- 67. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ГБОУ школа № 661
Санкт-Петербург
учитель химии
Ефремова С. А.
класс
10
Углеводороды и их
природные источники
Слайд 2§ 3. Природный газ. Алканы.
§ 4. Алкены. Этилен.
§ 5. Алкадиены.
Каучуки.
§ 6. Алкины. Ацетилен.
§ 7. Арены. Бензол.
§ 8. Нефть и
способы ее переработки.Слайд 4СН4 - метан
75-98%
С2Н6 - этан
4%
С3Н8 - пропан
2%
С4Н10
- бутан
1%
С5Н12 - пентан
1%
N2 и другие газы
4%
Примерный
состав природного газаСлайд 5Алканы – это предельные углеводороды, в молекулах которых все атомы
связаны одинарными связями. Состав их отражает общая формула:
СnH2n+2
Модель молекулы метана
Алканы
плохо растворимы в воде;С – С4 газы;
С5 – С15 жидкости;
С16 – … твердые вещества;
С увеличением молекулярной массы алканов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность веществ.
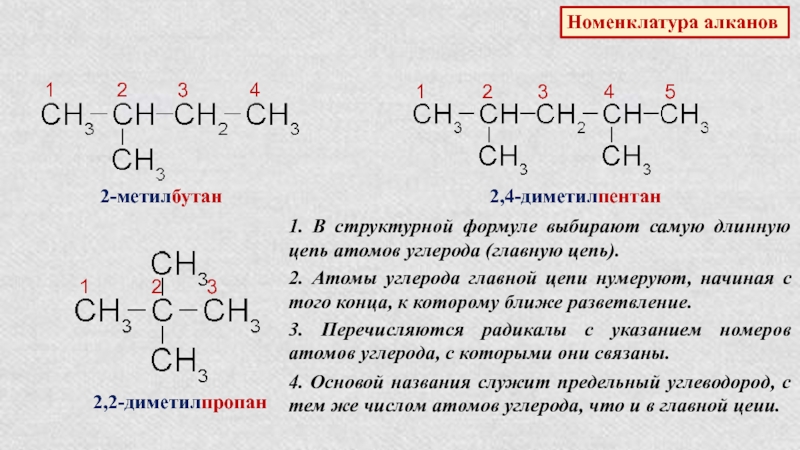
Слайд 7Номенклатура алканов
1 2
3 4
2-метилбутан
1
2 3 4 52,4-диметилпентан
1 2 3
2,2-диметилпропан
1. В структурной формуле выбирают самую длинную цепь атомов углерода (главную цепь).
2. Атомы углерода главной цепи нумеруют, начиная с того конца, к которому ближе разветвление.
3. Перечисляются радикалы с указанием номеров атомов углерода, с которыми они связаны.
4. Основой названия служит предельный углеводород, с тем же числом атомов углерода, что и в главной цеии.
Слайд 8Химические свойства алканов
1. Реакции замещения
Галогенирование
пропан
2-бромпропан (95%)
1-бромпропан (5%)
Нитрование
этан
разбавл.
нитроэтан
2. Горение
Слайд 9Химические свойства алканов
3. Изомеризация
бутан
метилпропан
4. Реакции разложения
Крекинг
гексадекан
октон
октан
Дегидрирование
пропан
пропен
Слайд 10Применение алканов
СН4
метан
Резина;
Картриджи;
Типографская краска;
Растворители;
Хладагенты;
Метанол;
Ацетилен;
Слайд 12Алкены – это непредельные углеводороды, содержащие в молекуле, кроме одинарных
связей, одну двойную углерод-углеродную связь. Состав их отражает общая формула:
СnH2n
С2Н4
этилен
Гомологический
ряд этиленаСлайд 13Структурная изомерия алкенов
1. Изомерия углеродного скелета
(начиная с С4Н8):
2 метилпропен-1
3 2
1 2. Изомерия положения кратной связи
(начиная с С4Н8):
СН3− СН = СН − СН3
4 3 2 1
бутен-2
3. Межклассовая изомерия с циклоалканами
(начиная с С3Н6):
пропен
циклопропан
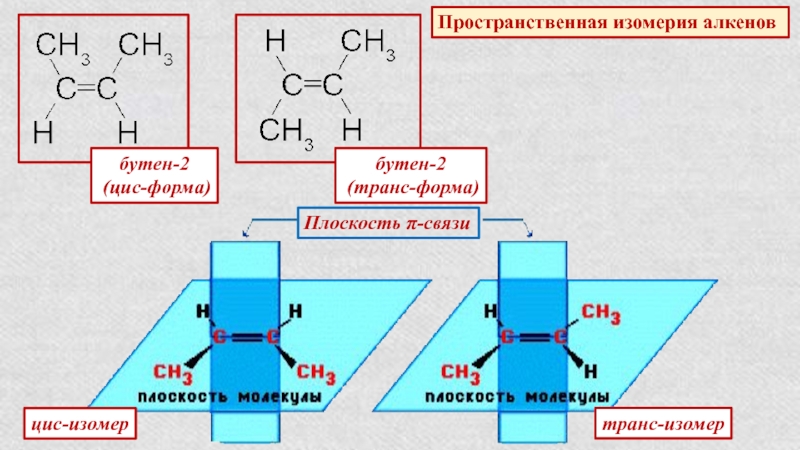
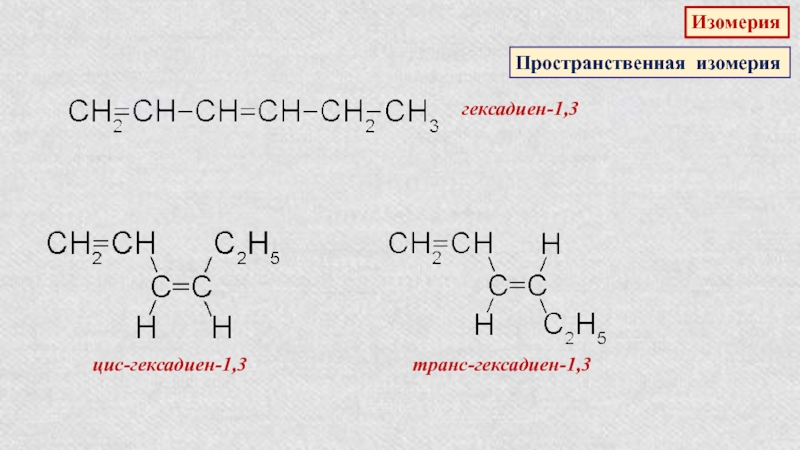
Слайд 14Пространственная изомерия алкенов
бутен-2
(цис-форма)
бутен-2
(транс-форма)
Плоскость π-связи
цис-изомер
транс-изомер
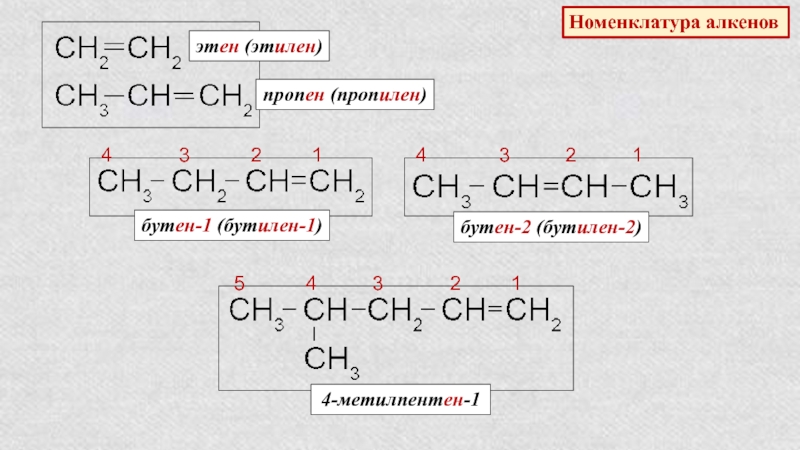
Слайд 15Номенклатура алкенов
этен (этилен)
пропен (пропилен)
4 3
2
1бутен-1 (бутилен-1)
4 3 2 1
бутен-2 (бутилен-2)
5 4 3 2 1
4-метилпентен-1
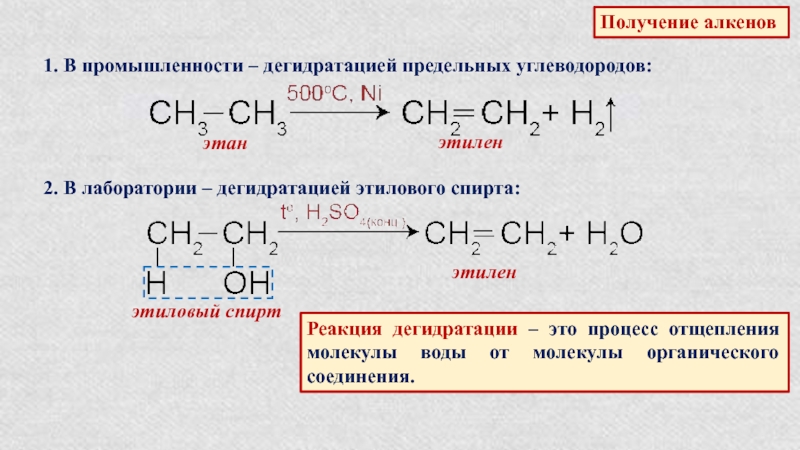
Слайд 16Получение алкенов
1. В промышленности – дегидратацией предельных углеводородов:
этан
этилен
2. В лаборатории
– дегидратацией этилового спирта:
этиловый спирт
этилен
Реакция дегидратации – это процесс отщепления
молекулы воды от молекулы органического соединения.Слайд 17Физические свойства
Алкены плохо растворимы в воде, но хорошо растворяются в
органических соединениях;
С2 – С4 – газы;
С5 – С16 – жидкости;
С17
– … – твердые вещества;С увеличением молекулярной массы алкенов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность вещества.
Слайд 18Химические свойства
1. Реакции ионного присоединения
Галогенирование
бутен-2
2,3-дибромбутан
Гидрогалогенирование
по правилу Марковникова
пропен
2-бромпропан
Гидратация
пропен
пропанол-2
Слайд 19Химические свойства
2. Реакции окисления
Мягкое окисление
Реакция Вагнера
3СН2=СН2+ 2KMnO4+ 4H2O →
3HO–CH2–CH2–OH + 2MnO2↓ + 2KOH
этиленглиголь
(этандиол-1,2)
3. Реакции гидрирования
этилен
этан
4.
Реакции полимеризацииэтилен (мономер)
полиэтилен (полимер)
Слайд 20Применение этилена
Стимулятор дозревания плодов;
С2Н4
этилен
производство полиэтилена;
производство растворителей;
производство уксусной кислоты;
производство антифризов.
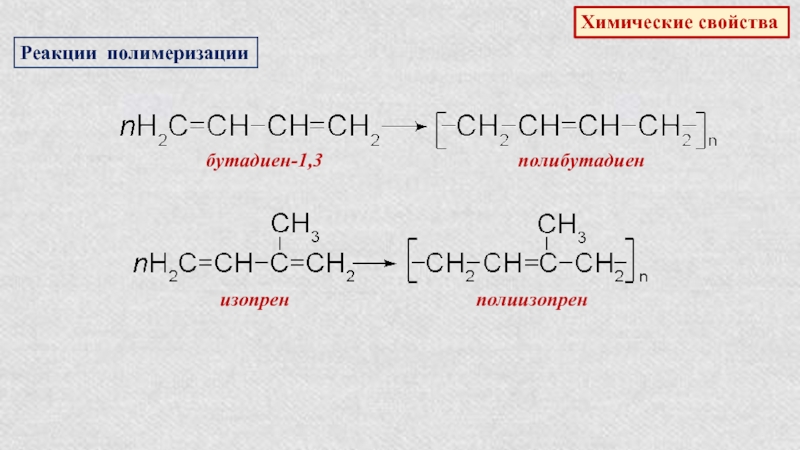
Слайд 22Алкадиены или диены – это непредельные углеводороды, содержащие в молекуле,
кроме одинарных связей, две двойные углерод-углеродные связи. Состав их отражает
общая формула:СnH2n-2
Диеновые углеводороды, в молекулах которых две двойные углерод-углеродные связи разделенные одной одинарной связью, называют сопряженными.
бутадиен-1,3
синтетический бутадиеновый
каучук
число молекул
число структурных звеньев
Сопряженные диены являются исходными веществами для получения синтетических каучуков.
Слайд 23Номенклатура
CH2=CH–CH2–СН=CH2
1 2
3 4
5Пента
диен
-1,4
- две двойные связи
- положение двойных связей
СН2=СН–СН=СН–СН3 пентадиен-1,3
1 2 3 4 5
СН2=С=СН–СН2–СН3 пентадиен-1,2
1 2 3 4 5
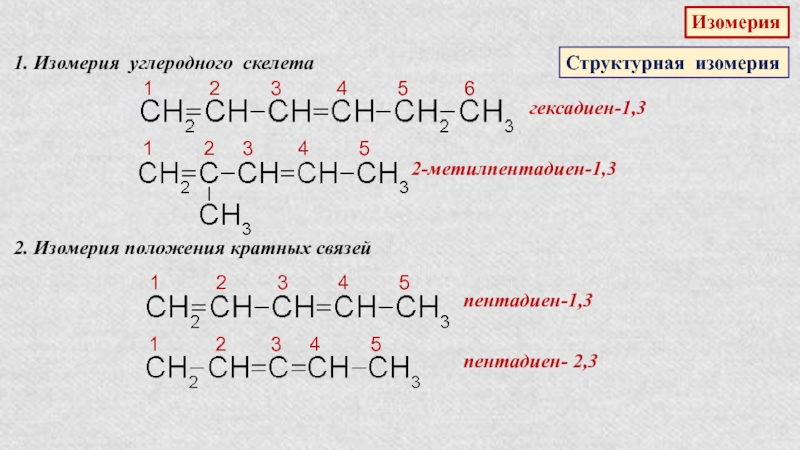
Слайд 24Изомерия
Структурная изомерия
1. Изомерия углеродного скелета
1 2
3 4
5 6гексадиен-1,3
1 2 3 4 5
2-метилпентадиен-1,3
2. Изомерия положения кратных связей
1 2 3 4 5
пентадиен-1,3
1 2 3 4 5
пентадиен- 2,3
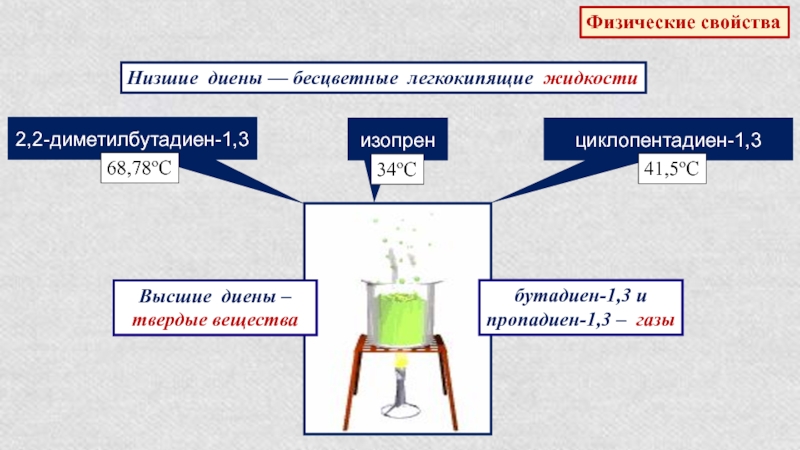
Слайд 26Физические свойства
Низшие диены — бесцветные легкокипящие жидкости
2,2-диметилбутадиен-1,3
68,78оС
циклопентадиен-1,3
41,5оС
изопрен
34оС
Высшие диены – твердые вещества
бутадиен-1,3
и
пропадиен-1,3 – газы
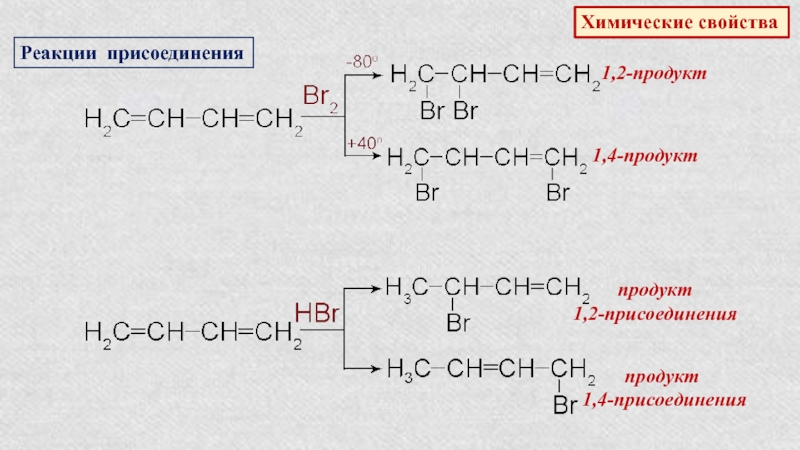
Слайд 27Химические свойства
Реакции присоединения
1,2-продукт
1,4-продукт
продукт
1,2-присоeдинeния
продукт
1,4-присоeдинeния
Слайд 29Каучук
Природный каучук
Гевея (каучуковое дерево)
цис-полиизопрен
отличается водо- и газонепроницаемостью;
хороший электроизолятор;
в воде практически
не растворяется;
в сероуглероде, хлороформе и бензине сначала набухает, затем растворяется;
при
повышенной температуре становится мягким и липким;на холоде становится твердым и хрупким;
при долгом хранении твердеет.
Слайд 30Каучук
Природный каучук
Изопреновые остатки в каучуке связаны по принципу «голова к
хвосту»:
остаток изопрена
Слайд 31Каучук
Вулканизация каучука
При нагревании каучука с серой (вулканизации) до температуры 130-140оС,
атомы серы присоединяются по месту некоторых двойных связей и как
бы «сшивают» молекулы друг с другомСлайд 32Каучук
Вулканизация каучука
В результате процесса вулканизации образуется резина, которая
значительно прочнее невулканизированного каучука.
Шины
Конвейерные ленты
Шланги
Непромокаемая
обувь
Если к каучуку при вулканизации добавить
больше серы, чем ее требуется для образования резины, то получают эбонит – твердый неэластичный материал.Слайд 34Алкины – это непредельные углеводороды, молекулы которых содержат, помимо одинарных
связей, одну тройную углерод-углеродную связь. Состав их отражает общая формула:
СnH2n-2
Родоначальником
гомологического ряда алкинов является ацетилен.С2Н2
Н–С≡С–Н
Масштабная модель
Атомно-орбитальная модель
Шаростержневая модель
Слайд 35Номенклатура
По номенклатуре ИЮПАК:
4,6-диметил-4-этил-5-хлоргептин-2
7 6
5 4
3 2 1Суффикс –ин означает принадлежность
соединения к алкинам.
По радикально-функциональной номенклатуре:
– пропилацетилен
– метилэтилацетилен
Слайд 36Структурная изомерия
Изомерия углеродного скелета (начиная с С5Н8):
СН≡С‒СН2‒СН2‒СН3
пентин-1
3-метилбутин-1
1
2 3 4
Изомерия
положения тройной связи (начиная с С4Н6):СН≡С‒СН2‒СН3
бутин-1
СН3−С≡С‒СН3
бутин-2
Межклассовая изомерия с алкадиенами и циклоалкенами (начиная с С4Н6):
СН≡С‒СН2‒СН3
бутин-1
СН2=СН−СН=СН2
бутадиен-1,3
циклобутен
Слайд 37Физические свойства алкинов
Алкины плохо растворимы в воде, хорошо – в
органических растворителях;
С2 – С4 – газы (н.у.);
С5 – С15 –
жидкости (н.у.);С16 – … – твердые вещества;
С увеличением молекулярной массы алкенов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность вещества.
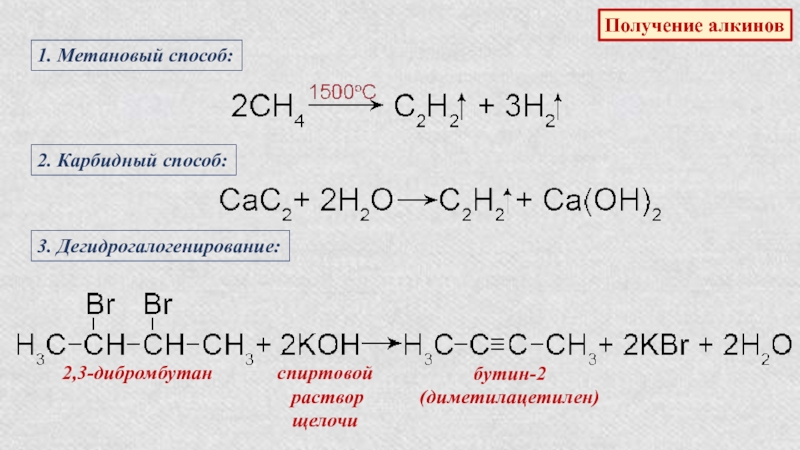
Слайд 38Получение алкинов
1. Метановый способ:
2. Карбидный способ:
3. Дегидрогалогенирование:
2,3-дибромбутан
спиртовой
раствор
щелочи
бутин-2
(диметилацетилен)
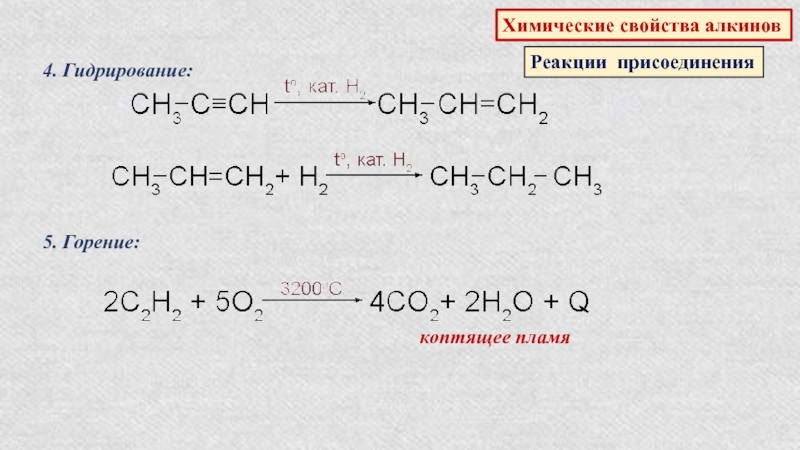
Слайд 39Химические свойства алкинов
Реакции присоединения
1. Галогенирование:
CH3‒C≡CH+Br2→CH3‒CBr=CHBr
1,2-дибромпропен-1
CH3‒CBr=CHBr+Br2→CH3‒CBr2‒CHBr2
1,1,2,2-тетрабромпропан
2. Гидратация (реакция Кучерова):
этаноль
(уксусный альдегид)
Слайд 40Химические свойства алкинов
Реакции присоединения
3. Гидрогалогенирование (правило Марковникова):
пропин-1
2-бромпропен-1
2,2-дибромпропан
Слайд 42Химические свойства алкинов
Реакции полимеризации
1. Димеризация под действием водно-аммиачного раствора CuCl:
НС≡СН
+ НС≡СН → Н2С=СН‒С≡СН
винилацетилен
2. Тримеризация ацетилена над активированным углем (реакция
Зелинского) :ацетилен (3 шт.)
бензол
С6Н6
Слайд 43Применение ацетилена
Поливинилхлорид
Автогенная сварка
Синтетический каучук
Синтетическое волокно
Уксусная кислота
Растворители
Слайд 45
Арены или ароматические углеводороды – это
соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей:СnH2n-6
С6Н6
БЕНЗОЛ
Бесцветная жидкость с характерным запахом, практически не растворяется в воде;
температура плавления – 5,5оС;
температура кипения – 80,1оС;
молекулярная масса – 78,11 г/моль;
с воздухом образует взрывоопасные смеси;
хорошо смешивается с бензином, эфирами, и другими органическими растворителями;
растворяет жиры, каучуки, серу, фосфор;
токсичен, канцерогенен.
Слайд 46
Номенклатура и изомерия
С6Н5–СН3
метилбензол
(толуол)
С6Н5–С2Н5
этилбензол
С6Н5–С3Н7
пропилбензол
1,2-диметилбензол
орто-ксилол
(о-ксилол)
1,3-диметилбензол
мета-ксилол
(м-ксилол)
1,4-диметилбензол
пара-ксилол
(п-ксилол)
Слайд 47
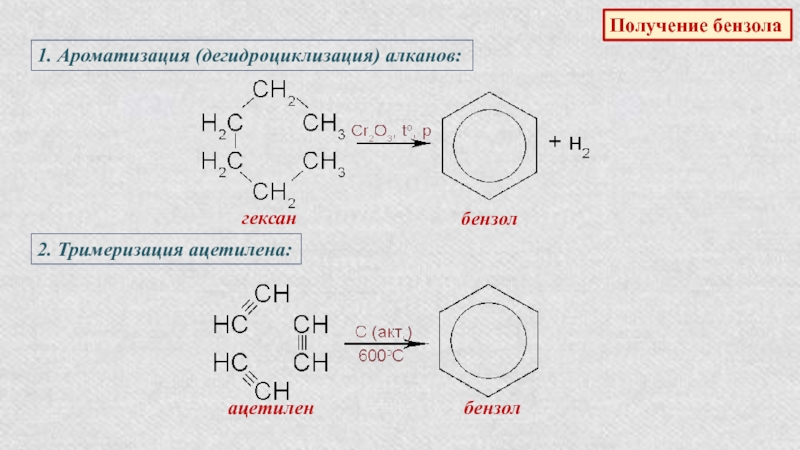
Получение бензола
1. Ароматизация (дегидроциклизация) алканов:
гексан
бензол
2. Тримеризация
ацетилена:ацетилен
бензол
Слайд 50
Химические свойства бензола
Реакции присоединения
1. Хлорирование:
бензол
гексахлорциклогексан
2. Гидрирование:
бензол
циклогексан
Слайд 52Физические свойства нефти
густая маслянистая горючая жидкость;
цвет от светло-коричневого до темно-бурого;
легче
воды (плотность от 0,65 до 1,05);
в воде не растворяется;
нет определенной
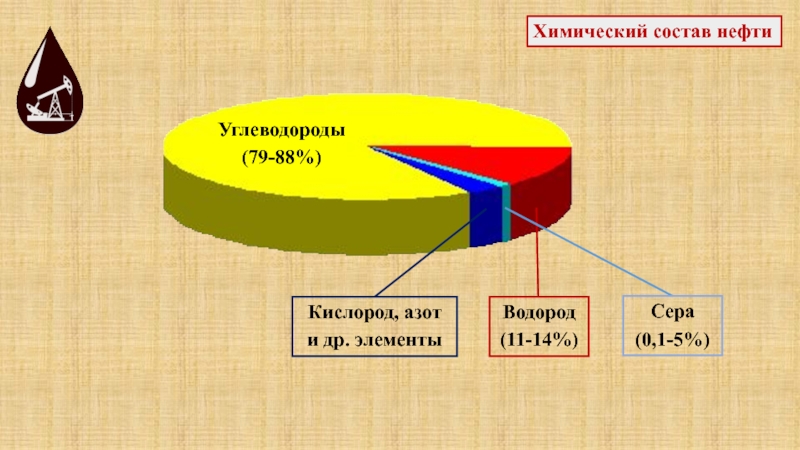
температуры кипения, т.к. нефть – смесь различных углеводородов.Слайд 53Химический состав нефти
Углеводороды
(79-88%)
Водород
(11-14%)
Сера
(0,1-5%)
Кислород, азот
и др. элементы
Слайд 55Назад
Фонтанный способ добычи нефти
Подъем нефти на поверхность осуществляется за счет
пластовой энергии.
Слайд 56Назад
Нефть из пласта поднимается на поверхность энергией газа, закачиваемого в
скважину.
Газлифтный способ добычи нефти
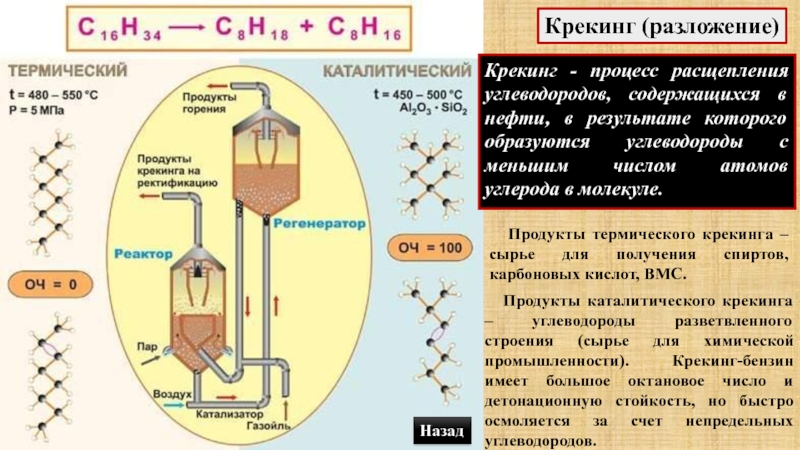
Слайд 60Крекинг (разложение)
Крекинг - процесс расщепления углеводородов, содержащихся в нефти, в
результате которого образуются углеводороды с меньшим числом атомов углерода в
молекуле. Продукты термического крекинга – сырье для получения спиртов, карбоновых кислот, ВМС.
Продукты каталитического крекинга – углеводороды разветвленного строения (сырье для химической промышленности). Крекинг-бензин имеет большое октановое число и детонационную стойкость, но быстро осмоляется за счет непредельных углеводородов.
Назад
Слайд 61Риформинг (ароматизация)
Риформинг – переработка нефтепродуктов (главным образом бензиновых и лигроиновых
фракций нефти) при 490-540оС с целью получения высокооктановых автомобильных бензинов,
ароматических углеводородов и технического водорода.Назад
Слайд 62Фракции после перегонки сырой нефти
Газовая фракция.
Метан и другие
газы.
2. Бензин (С5 – С11).
Температура кипения –
40-200оС. Газолин, бензин авиационный, автомобильный. 3. Лигроин (С8 – С14).
Температура кипения – 120-240оС. Горючее для тракторов, сырье для крекинга.
3. Керосин (С12 – С18).
Температура кипения – 150-310оС. Топливо для реактивных самолетов и ракет, осветительный и тракторный керосин.
3. Газойль (С18 и выше).
Температура кипения – 275оС. Дизельное топливо, сырье для крекинга.
Мазут.
Продукт, остающийся после ректификации нефти. Мазут при высокой температуре разгоняют и получают машинные и смазочные масла. Остаток переработки мазута – гудрон, нефтяной асфальт.
Слайд 63Детонационная стойкость бензина
Детонационная стойкость — параметр, характеризующий способность
топлива противостоять самовоспламенению при сжатии.
Дистанционную стойкость бензина характеризует октановое число:
стойкость гептана принимается за 0, а изооктана – за 100.Детонационную стойкость повышают, добавляя антидетонаторы, например, тетраэтилсвинец (ТЭС). Он ядовит. При работе с этилированным бензином следует быть осторожным, следить за цветом бензина.
А72 – розовый,
А76 – желтый,
А93 – светло-красный,
АИ98 – синий.
Слайд 65Экологические проблемы использования нефтепродуктов
Ежегодно в Мировой океан сбрасывается до 10
миллионов тонн нефти…
Слайд 66Список использованных материалов
– О.С.Габриелян. Химия 10 класс. Учебник. Базовый уровень.
Глава первая.
– Г.Е.Рудзитис, Ф.Г.Фельдман. Химия 10 класс. Учебник. Базовый уровень.
https://yandex.ru/search/?lr=2&clid=2270453&win=386&text=пространственная%20изомерия%20алкенов
–
Слайд 14. Пространственная изомерия алкенов – схема:– Слайд 64. Продукты переработки нефти – схема:
https://yandex.ru/search/?lr=2&clid=2270453&win=386&text=продукты%20переработки%20нефти%20схема
– Слайд 65. Экологические проблемы использования нефтепродуктов:
https://yandex.ru/images/search?from=tabbar&text=экологические%20проблемы%20использования%20нефтепродуктов&pos=3&img_url=https%3A%2F%2Ffs00.infourok.ru%2Fimages%2Fdoc%2F174%2F199887%2Fimg10.jpg&rpt=simage