Слайд 1
Батыс Қазақстан облысы
Зеленов ауданы
Махамбет ауылы
Махамбет ЖОББМ
Химия пәнінің мұғалімі
Лекерова Эльмира Қайратқызы
Слайд 2
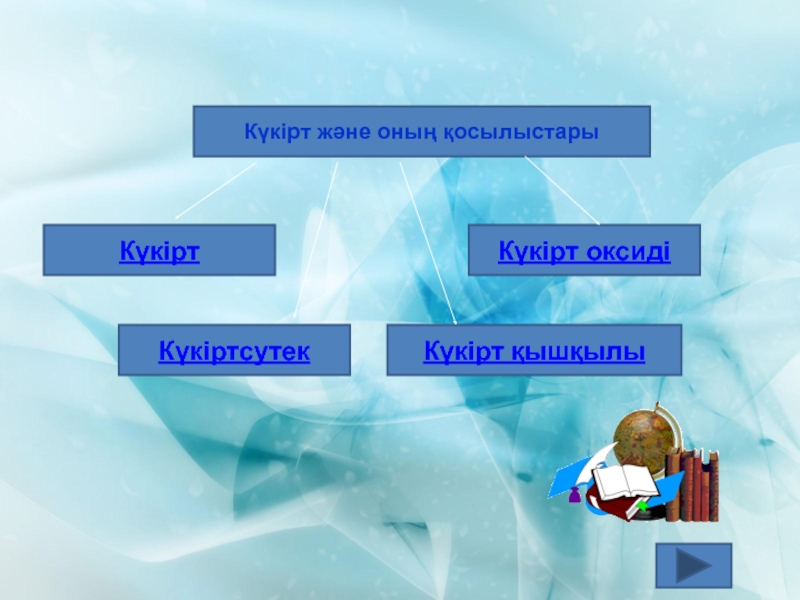
Күкірт және оның қосылыстары
Слайд 3Сабақтың мақсаты:
1.Оқушыларды күкірт және оның қосылыстарымен,химиялық
қасиеттерімен таныстыру
2.Жоспарды пайдалана отырып,өз бетінше
жауап беру біліктілігін қалыптастыру,негізгі ойды бөліп қорытындылап,салыстыра білуге үйрету
3.Уақытты бағалауға,өз бетінше жұмыс істеп,қорытындылай білуге үйрету
Слайд 4Сабақ жоспары:
І. Ұйымдастыру
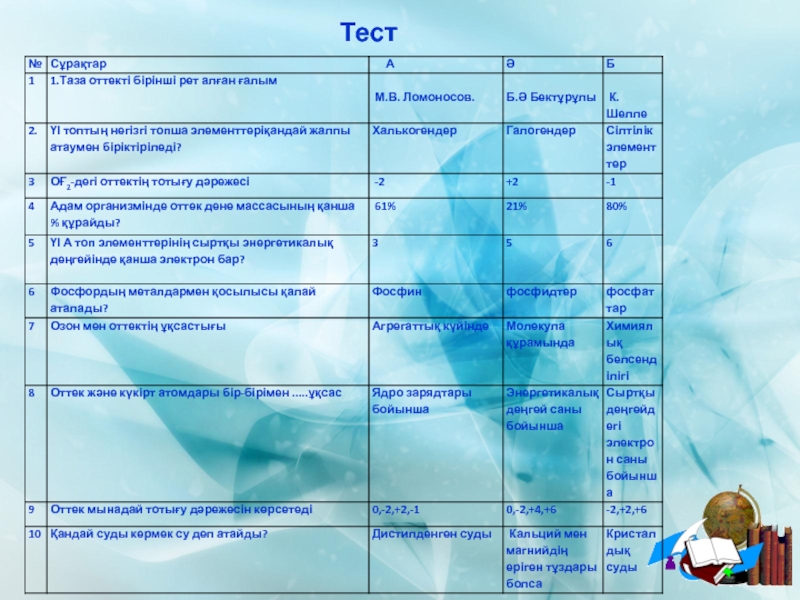
ІІ. Үй тапсырмасын пысықтау. (тест)
ІІІ.
Сабақтың мақсатымен таныстыру
ІV. Топқа бөлу
Слайдпен жұмысты қорғау
VІ.Өздік жұмыс
VІІ.Қорытындылау
Слайд 6Осы затпен ескі үйді аластайды,түсіне қарасаң алтынға ұқсайды
бұл не деп
ойлайсыңдар, балалар?
Иә , бұл күкірт.
Ендеше бүгінгі сабағымызда «Күкірт және
оның қосылыстары»
туралы әңгімелейтін боламыз.
Сыныпты 4 топқа бөлу.
«Күкірт және оның қосылыстары» тақырыбы бойынша оқушылардың
слайд бойынша жұмыстарын қорғауы.
І топ «Күкірт»
ІІ топ «Күкіртсутек»
ІІІ топ «Күкірттің (ІV,VІ ) оксидтері
ІҮ топ « Күкірт қышқылы»
Слайд 7Күкірт және оның қосылыстары
Күкіртсутек
Күкірт қышқылы
Күкірт
Күкірт оксиді
Слайд 9Табиғатта таралуы және физикалық қасиеттері
Күкіртсутек –шіріген жұмыртқа йісті,түссіз газ.
-60°с-та сұйық
күйге ауысады.ал -86° с-та қатады.
Күкіртсутек табиғатта жанартау атқылағандағы газдардың құрамында,емдік
қасиеті бар минерал суларда кездеседі(Алма-Арасан т.б)
Күкіртсутек өте улы,оның өте аз мөлшерімен тыныс алғанда адам есінен танып,тіпті өліп те кетуі мүмкін.
Күкіртсутек тыныс алғанда гемоглобинмен байланысып,сал ауруын туғызады.
Күкіртсутекпен уланған адамды тез арада таза ауаға шығару керек.
Слайд 10Химиялық қасиеттері
Күкіртсутеке тотықсыздандырғыш қасиет тән.
2Н2S +O2→2S+2H2O S- тот-с-ш , O2-
т-т-ш
Металдармен әрекеттесіп сутек бөледі,активтік қатарында сутекке дейін тұрған металдармен:
Н2S+Mg →
Mg S+ Н2↑
Галогендермен әрекеттескенде сәйкес галогенсутек қышқылдарын түзеді: Br2 + Н2S →2HBr+S
Күкіртсутек екі негізді қышқыл болғандықтан,орта(сульфидтер)және қышқыл тұздар(гидросульфаттар) түзеді. Н2S+КОН →КНS+H2O
Слайд 11Алынуы:
Зертханада:
Н2S Кипп аппаратында алынады:
ҒеS+ 2HCI → Н2S↑ + ҒеCI2
Слайд 12Қолданылуы:
Күкіртсутек емдік қасиеті бар,буын ауруларын емдеуде күкіртті сутек ванналарында қолданылады
Күкірттісутектің
тұздарымен түсі әр түрлі тұнба түзуі аналитикалық химияда ерітіндіден сәйкес
металл катиондарын бөлуде және анықтауда қолданылады
Слайд 14Физикалық қасиеттері
Күкірт екі түрлі оксид түзеді:S(ІҮ)оксиді-SO2(күкіртті газ немесе күкірттің диоксиді),бұл-өткір
тұншықтырғыш иісі бар,түссіз газ
S(ҮІ)оксиді-күкірт ангидриді- SO3,ұшқыш,түссіз сұйықтық;олар суда жақсы ериді,нәтижесінде
күкіртті қышқыл Н2SO3 және күкірт қышқылы Н2SO4 түзіледі,олай болса бұлар қышқылдық оксидтер
Слайд 15Алынуы
Зертханада: Күкіртті ауада жағу арқылы 2S+O2→ SO2
Өндірісте: 2ZnS+3O2 → 2ZnO+
2SO2
2SO2+O2 → 2SO3
Слайд 16Химиялық қасиеттері
Негіздік оксидпен әрекеттесіп тұз түзеді:
SO2+Na2O→Na2SO3
Негізбен әрекеттескенде тұз және
су түзе жүреді
SO2+2 NaOH →Na2SO3+H2O
Слайд 17Қолданылуы
SO2-қантты,маталарды,сабынды ағарту үшін,қоймаларды аластау үшін қолданылады.
Слайд 19Физикалық қасиеттері
Күкірт қышқылы-түссіз, ұшқыштығы төмен, тығыздығы 1,84г\мл майлы сұйықтық
Кейде
оны “купорос майы” деп атайды.
Ылғал тартқыш
Күкірт қышқылы суда жақсы
ериді. Еру кезінде көп мөлшерде жылу бөлінеді
Ауадан және басқа газдардан су буын жақсы тартады
Слайд 20Химиялық қасиеттері
Күкірт қышқылы күшті және белгілі минералды қышқылдар ішіндегі тұрақтысы
Сұйылтылған
күкірт қышқылына күшті қышқылдың барлық қасиеттері тән. Олар негіздік оксидтермен,
негіздермен және тұздармен әрекеттеседі.
Кернеу қатарындағы сутектің оң жағындағы металдар сұйылтылған күкірт қышқылында ерімейді.
Слайд 21Сульфат иондарына сапалық реакция
Күкірт қышқылына және оның тұздарына барий тұздарының
ерітіндісі реактив болып табылады. Ва2 катионы SО4 анионымен іс жүзінде
ерімейтін ақ тұнба түзеді:
Ba2 + SO4 = BaSO4
Слайд 22Қолданылуы
Күкірт қышқылымен тікелей немесе жанама байланыспаған химиялық өндіріс салаларын айту
қиын. Күкірт қышқылы жан-жақты қолданылуы бойынша бірінші орында тұр. Оны
химия өнеркәсібінің “наны” деп санайды, себебі басқа қышқылдарды алуда, мұнай өнімдерін тазалауда, қант өндірісінде, өсімдік майын тазалауда, газдарды құрғатуда, сода, бояу, жасанды талшық өндірісінде, органикалық синтез және т.б. қолданылады
Негізгі химиялық өнеркәсіпте күкірт қышқылы тыңайтқыштар алуда қолданылады
Слайд 23Сульфаттар
Күкірт қышқылының тұздарын сульфаттар деп атайды. Күкірт қышқылы екінегізді болғандықтан,
ол тұздарды екі қатарына түзеді: орта-сульфаттар және қышқыл-гидросульфаттар
Күкірт қышқылының
тұздары да өте көп қолданылады. Күкірт қышқылы тұздарының ішіндегі тұздарына маңыздыларына мыналар жатады:
Кальций сульфатыCASO4 кристалгидрат түрінде кездеседі:гипс,алебастр.Гипсті кыздырганда ол алебастрга айналады.Алебастрды медицинада сынақтың сыртынан орап таңуда және тіс протезін дайындауда қоолданады
Слайд 25Периодтық жүйедегі орны және атом құрылысы
Күкірт VІ А топ элементі.
Электрондық
формуласы: S 1s2 2s2 2p6 3s2 3p4
Слайд 26Физикалық қасиеттері
Күкірт –сары түсті,қатты кристалды зат
Оның үш аллотропиялық түр өзгерісі
болады: ромбтық,моноклинді,пластикалық
Қалыпты жағдайда күкірт молекуласы сақина түріндетұйықталған сегіз атомнан
тұрады
Суда күкірт ерімейді,спирт пен эфирде нашар ериді;бензолда,күкіртті көміртекте және т.б.жақсы ериді
Слайд 27Химиялық қасиеттері
Күкірт химиялық реакцияларда тотықтырғыш та,тотықсыздандырғыш та бола алады
күкірттің жай
заттармен әрекеттесуі
күкірт жоғары температурада сутекпен әрекеттеседі
Жоғары температурада күкірт фтормен және
оттекпен әрекеттеседі(жанады)
Слайд 28Табиғатта таралуы
Күкірттің табиғи қосылыстары
Балқаш,Шығыс Қазақстан облысында сульфидтер( ZnS,PbS, FeS,т.б)күйінде болса,сульфаттары
(СаSO4.
2 H2 O, Na2 SO4 .10H2 O, MgSO4 . 7H2
O) т.б болады
Күкірт қосылыстары мұнайда және тас көмірде де кездеседі
Бос күйіндегі күкіртті тау жыныстарынан балқыту арқылы алады
Слайд 29
ҮІ.Өздік жұмыс.
І топ
1.Күкірттің химиялық таңбасы
2.Электрондық формуласы
3.Мүмкін болатын валенттігі
4.Мүмкін болатын тотығу дәрежесі
ІІ топ
Мына қосылыстардың ішінен күкіртті қосылыстардың формуласын тауып ,атын ата:
СаО,Н2S, NaOH ,SO2, H 2O, HNO3,MgCI2 ,Fe2 (SO 4)3
2.Күкірттің (ІҮ) оксиді ....оксид деп аталады
Күкірттің (ІҮ) оксиді сумен әрекеттесіп,түзеді
4.Күкірт қышқылының формуласы
ІІІ топ
1.Күкірт қышқылына және оның тұздарына қай зат сапалық реактив болып табылады ?
2.Күкірт қышқылының физикалық қасиеттері қандай?
3.Мына реакция теңдеуін аяқта: а) Mg+H2S O4→ ә) Zn O+ H2S O4→ б) Na3 PO4 + H2S O4→
ІҮ топ
1.Мына айналымды жүзеге асыр: S → SO2 → SO3 → H2 S O4 → K2 S O4
2.Күкірттің қанша аллотропиялық түр өзгерістері бар?
3.Мына реакциялар ды аяқта : а) SO 2+ K2 O→ ә) Fe S+ O2→ б) Zn S+ O2→
Слайд 30
Сергіту сәті.
1.Екі буыннан тұратын химиялық элемент,
Бірінші буыны атау септігінің
сұрағы,екінші буыны сан есім, бұл қандай элемент? (неон)
2.Бірінші буыны тасқын
су, екінші буыны мал құлағындағы белгі.
Оқушы ,ойлан, бұл қандай элемент?(селен)
3.Табылса бұрын там-тұмнан ,қазір көп әрбір өлкеде.
Қымбат болды алтыннан ,қандай металл ертеде. (алюминний)
4.Сыныптан бір шықпайды,тимесең жұқпайды.
Жәрдемісіз бұл заттың,оқушы сабақ ұқпайды (бор)
5.Күмістей түсі жылтыр,өзі сұйық,буланбас,қайнатсаң да отынды үйіп.
Көрсететін суықты,жылуды анық ,қандай зат;құрал жасар соны құйып?(сынап)
Слайд 31
ҮІІ.Қорытындылау
Әр топ өздерінің аттарына сәйкес тақырыптарын түйіндейді
ІХ. Бағалау
Х.Үйге тапсырма беру
«Күкірт
оның қосылыстары тақырыбын»оқу