Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Металлы. Строение, свойства, применение.
Содержание
- 1. Металлы. Строение, свойства, применение.
- 2. СодержаниеХарактеристика элемента-металла по положению в ПСХЭИзменение металлических
- 3. Характеристика элемента – металла по положению в
- 4. Изменение металлических свойств в ПСХЭ В группах:
- 5. Металлы –простые вещества
- 6. Химическая связь в металлах В
- 7. Физические свойства металлов
- 8. Физические свойства металлов
- 9. Металлы - «рекордсмены» W
- 10. Химические свойства металловВсе металлы проявляют только восстановительные
- 11. Взаимодействие металлов с кислородом
- 12. Взаимодействие металлов с галогенами o
- 13. Взаимодействие металлов с кислотамиZn + 2HCl →
- 14. МеталлотермияНекоторые активные металлы – литий, магний, кальций,
- 15. О применении металлов
- 16. Металлы древности на службе у человека
- 17. Из истории сплавов
- 18. Из истории сплавов (продолжение)
- 19. Чугун –материал для создания шедевров мирового искусства
- 20. Чугун – материал для создания шедевров мирового
- 21. Чугун –материал для создания шедевров мирового искусства
- 22. Чугун – материал для создания шедевров мирового
- 23. Чугун – материал для создания шедевров
- 24. Чугун –материал для создания шедевров мирового искусства
- 25. О роли металлов
- 26. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Содержание
Характеристика элемента-металла по положению в ПСХЭ
Изменение металлических свойств в ПСХЭ
Металлы
– простые вещества
Химическая связь в металлах
5. Физические свойства
6. Металлы
– рекордсмены Химические свойства металлов
О применении металлов
Металлы древности на службе у человека
10. Из истории сплавов
11. Чугун-материал для создания шедевров мирового искусства
12. О роли металлов
Слайд 3Характеристика элемента – металла по положению в ПСХЭ Д.И.Менделеева
Li
B
1. Металлы находятся в I-III группе главнойподгруппе (искл. H -1e, Hе-2e, B-3e),
а также в I-VIII группах побочной подгруппе.
Fr At 2. На внешнем энергетическом уровне у
металлов от 1 до 3-х электронов.
3. Ме0 - п е = Ме+п (окисление)
восстановитель
4. Степень окисления металла:
0, +1, +2, +3 (низшая)
+4, +5, +6, +7, +8 (высшая)
Слайд 4Изменение металлических свойств в ПСХЭ
В группах:
металлические свойства усиливаются
причина: 1.увеличивается заряд ядра,2.число электронов на внешнем э.у.
не изменяется
3.радиус атома увеличивается
В периодах:
металлические свойства уменьшаются
причина: 1. увеличивается заряд ядра
2. число электронов на внешнем э.у.
увеличивается
3. радиус атома уменьшается
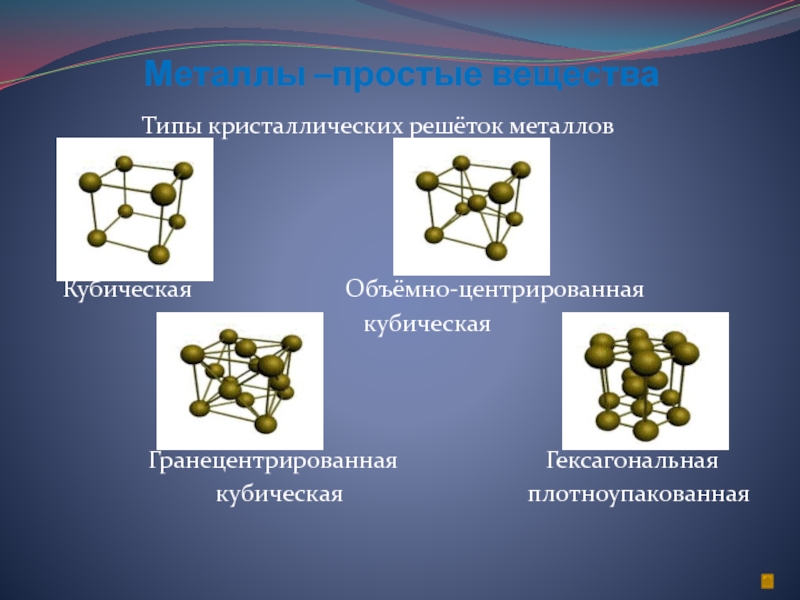
Слайд 5Металлы –простые вещества
Типы кристаллических решёток металлов
Кубическая
Объёмно-центрированная кубическая
Гранецентрированная Гексагональная
кубическая плотноупакованная
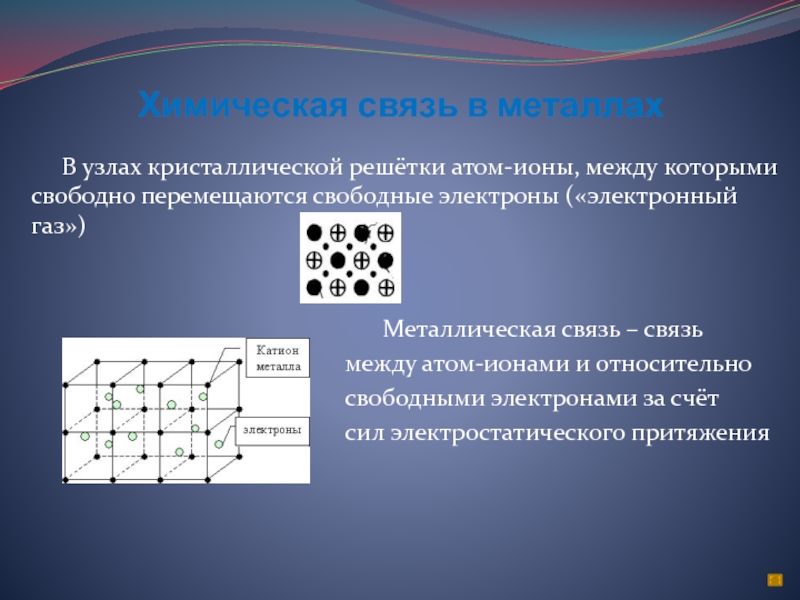
Слайд 6Химическая связь в металлах
В узлах кристаллической решётки
атом-ионы, между которыми свободно перемещаются свободные электроны («электронный газ»)
Металлическая связь – связь
между атом-ионами и относительно
свободными электронами за счёт
сил электростатического притяжения
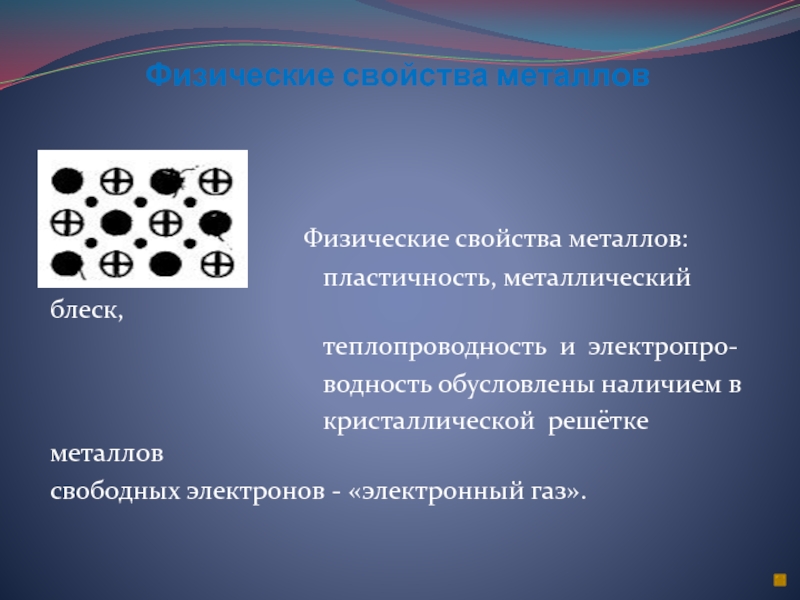
Слайд 7Физические свойства металлов
теплопроводность
твёрдость плотность
металлический пластичность
блеск и ковкость
электропроводность
Слайд 8Физические свойства металлов
Физические свойства металлов:
пластичность, металлический блеск,
теплопроводность и электропро-
водность обусловлены наличием в
кристаллической решётке металлов
свободных электронов - «электронный газ».
Слайд 9Металлы - «рекордсмены»
W - самый тугоплавкий
Ag - самый электропроводный
Li - самый лёгкийAI - самый распространённый
Cs - самый легкоплавкий
Au - лучший катализатор
Cr - самый твёрдый
Os - самый тяжёлый
Слайд 10Химические свойства металлов
Все металлы проявляют только восстановительные свойства
Атомы металлов легко
отдают электроны внешнего (а некоторые – и предвнешнего) электронного слоя,
превращаясь в положительные ионы.Металлы имеют большой атомный радиус и малое число электронов (от 1 до 3) на внешнем слое.
Исключение:
Ge, Sn, Pb ─ 4 электрона;
Sb, Bi ─ 5 электронов;
Po ─ 6 электронов
Слайд 11Взаимодействие металлов с кислородом
O O
+1 -24Li + O2 → 2Li2O
o o +2 -2
2Mg + O2 = 2MgO
o o +1 -1
2Na + O2 → Na2O2
to
Na2O2 + O2 → 2Na2O
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
Активные
металлы
4Al + O2 → 2Al2O3
3Fe + 2O2 = Fe3O4
Малоактивные
металлы
Слайд 12Взаимодействие металлов с галогенами
o
o
+1 -12Na + Cl2 → 2NaCl
2Fe + 3Cl2 → 2FeCl3
Взаимодействие металлов с водой
Взаимодействие металлов с серой
Fe + S → FeS
2Al + 3S → Al2S3
2Me + 2H2O = 2MeOH + H2
(для щелочных и щелочноземельных металлов)
3Fe + 4H2O → Fe3O4 + 4H2↑
(малоактивные металлы)
Слайд 13Взаимодействие металлов с кислотами
Zn + 2HCl → ZnCl2 + H2
2CH3COOH
+ Zn → (CH3COO)2Zn + H2
Взаимодействие металлов с солями
Fe +
CuSO4 → Cu↓ +FeSO4Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
Слайд 14Металлотермия
Некоторые активные металлы – литий, магний, кальций, алюминий – способны
вытеснять другие металлы из их оксидов. Это свойство используют для
получения некоторых металлов, а также для приготовления термитных смесей.2Al + Cr2O3 = Al2O3 + 2Cr
Слайд 15О применении металлов
Медь была первым металлом,
которым овладел человек. Она
открыла эру металлургии и дала
миру первый сплав. Многие
тысячелетия медь была основой
материальной культуры и искусств
Трудно переоценить уникальную
роль меди в истории
человеческой цивилизации.
Слайд 16Металлы древности на службе
у человека
Семь металлов создал свет
по числу семи планет …
Алхимики
Золото (Au) – солнце
Серебро (Ag) – луна
Ртуть (Hg) – меркурий
Медь (Cu) – меркурий
Железо (Fe) – марс
Олово (Sn) – юпитер
Свинец (Pb) – сатурн
Слайд 17Из истории сплавов
Бронза была первым сплавом,
полученным человеком.
Распространение бронзы началось
с конца 4 тыс. до н.э. Древнейшие
бронзовые изделия найдены на
территории Ирана, Месопотамии, Турции. В конце 3 тыс. до н.э. бронза появилась в Индии, во 2 тыс. до н.э. – в Китае и Европе.
В Америке бронзовый век охва-
тывает период с VI по Х века н.э.
Слайд 18Из истории сплавов
(продолжение)
В железный век первыми пришли
народы Африки. Они перешагнули
из каменного века в железный
минуя медный и бронзовый. Это
связано с тем, что в Африке железные
руды выходят на поверхность земли.
Африканцы изобрели плавку железа в 600-400
годах до новой эры.
Слайд 19Чугун –материал для создания шедевров мирового искусства
Санкт-Петербург –своеобразный музей, в котором
собрано бесчисленное множество
произведений изобразительного искусства, выполненных из чугуна.
Рассмотрит лишь некоторые
из них – чугунные ограды
дворцов и набережных рек
Санкт – Петербурга.
Слайд 20Чугун – материал для создания шедевров мирового искусства (продолжение)
Воронихинская решётка
у Казанского
собора. Отлита в 1811 году.
(Архитектор Воронихин А.Н.)
Слайд 21Чугун –материал для создания шедевров мирового искусства (продолжение)
Решётка Летнего сада. 36 гранитных колонн,
увенчанных вазами и урнами, и тончайшие ажурные звенья, украшенные позолоченными розетками, стали сокровищем мирового искусства.(Архитекторы Фельтен Ю.М. и Егоров П.Е.)
Слайд 22Чугун – материал для создания шедевров мирового искусства (продолжение)
Ограда Русского музея
(Михайловского дворца),
1819-1825 г
(Архитектор Росси К.И.)
До 1917 года назывался
музеем Александра III.
Слайд 23 Чугун – материал для создания шедевров мирового искусства (продолжение)
Ограда набережной реки Фонтанки. Сооружена в 1780-1789 г по проекту архитектора Квасова А.В.
Слайд 24Чугун –материал для создания шедевров мирового искусства (продолжение)
Ограда набережной
реки Мойки
(1798-1810 годы)