Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
АЛКИНЫ
Содержание
- 1. АЛКИНЫ
- 2. 23Неполное окисление кислородом окислителя (KMnO4 в нейтральной
- 3. C2H5CH3C2H5CH3Реакции окисленияИз дизамещенных гомологов ацетилена при окислении
- 4. Реакции замещения (замещение атомов «H», связанных
- 5. Реакции замещения (замещение атомов «H», связанных с
- 6. Реакции замещения (замещение атомов «H», связанных с
- 7. Реакции замещения (замещение атомов «H», связанных с
- 8. Реакции изомеризации
- 9. Обобщение II. Реакции окисленияIII. Реакции замещенияIV. Реакции
- 10. В промышленности Термическое разложение природного газа
- 11. В лаборатории Гидролиз карбида кальция (реакция Велера
- 12. CH3 – CH2 –C – C –
- 13. Получение гомологов ацетиленаАлкилирование ацетиленидовCH3 – C ≡
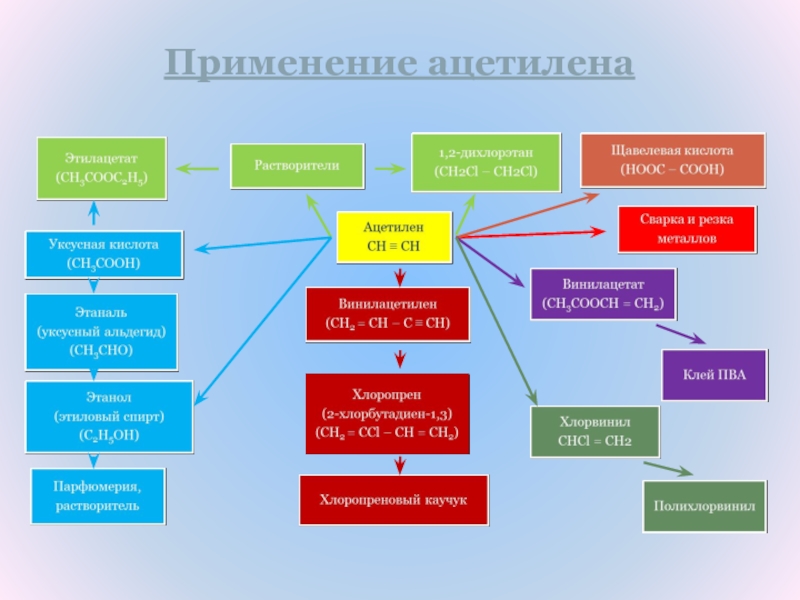
- 14. Применение ацетилена
- 15. Домашнее задание
- 16. Используемая литература«Репетитор по химии (издание 15-ое)», под
- 17. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ДМИТРИЕНКО К. Е., УЧИТЕЛЬ ХИМИИ
МОУ
КАЙГОРОДСКАЯ СОШ
КРАСНОЗЕРСКОГО РАЙОНА
НОВОСИБИРСКОЙ ОБЛАСТИ
Слайд 22
3
Неполное окисление кислородом окислителя (KMnO4 в нейтральной среде,
K2Cr2O7 в кислой среде) – конечным продуктом реакции
являются карбоновыекислоты.
(обесцвечивание раствора KMnO4 – это качественная реакция на
непредельные углеводороды: алкины обесцвечиваются быстрее, чем алкены)
2
O
Mn
K
–
O O
\\ //
H O – C – C – O H
Реакции окисления
H – C ≡ C – H
+
K
Mn
4
– C – C –
H
H
O
O
\\
//
O
O
–
+
8
+
4
H2O
8
KOH
+
8
MnO2
3
3
этандиовая кислота
(щавелевая кислота)
Но так как кислота взаимодействует со щелочью, то более правильно следует писать:
H – C ≡ C – H
KMn O4
+
O O
\\ //
K O – C – C – O K
+
H2O
+
KOH
+
Mn O2
оксолат калия
C
-1
-1
+3
- 8ē
C
+3
-1
+3
2
2
+7
+4
Mn
+7
+ 3ē
Mn
+4
24
3
8
3
C2
-1
- 24ē
C2
+3
8
Mn
+7
+ 24ē
Mn
+4
3
8
3
8
3
3
3
8
8
8
8
2
3
2
3
8
2
8
3
ацетилен
ацетилен
KOH
O
C ≡ C
C – C
Mn
Mn
K
K
K
K
H
H
H
H
Слайд 3C2H5
CH3
C2H5
CH3
Реакции окисления
Из дизамещенных гомологов ацетилена при окислении образуются соответствующие
R –
C
C –
+
[O]
+
H2O
из KMnO4
O
//
– C
\
OH
+
O
\\
C –
/
HO
≡
≡
//
\\
O
O
/
\
O
O
H
H
+
– C
одноосновные карбоновые кислоты
R
R
R´
R´
ацетилен
этановая кислота
пропановая кислота
метил
этил
CH3– C
≡
C – H
≡
+
[O]
+
H2O
3
3
из KMnO4
O
//
CH3 – C
\
OH
O
\\
C –
/
HO
+
H
\\
//
\
/
CH3– C
O
O
O
O
H
H
+
O
Из монозамещенных гомологов ацетилена при окислении образуются соответствующая
одноосновная карбоновая кислота и муравьиная кислота,
которая тоже окисляется
до угольной кислоты,
разлагающейся на углекислый газ и воду.
непредельные углеводороды (алкины обесцвечиваются быстрее, чем алкены).
Обесцвечивание щелочного раствора KMnO4 – это качественная реакция на
пропин
уксусная кислота
муравьиная кислота
(т. е. H2CO3)
+
CO2↑
H2O
4
(метилацетилен)
угольная кислота
Слайд 4Реакции замещения
(замещение атомов «H», связанных с sp-гибридизованными атомами углерода)
Атомы
водорода, связанные с sp-гибридизованными атомами
углерода в молекулах алкинов, обладают
значительной подвижностью (что объясняется поляризацией связи ≡C–H), поэтому
они могут замещаться атомами металлов – в результате чего
образуются ацетилениды.
Способность к таким реакциям отличает алкины от
других непредельных углеводородов.
Слайд 5
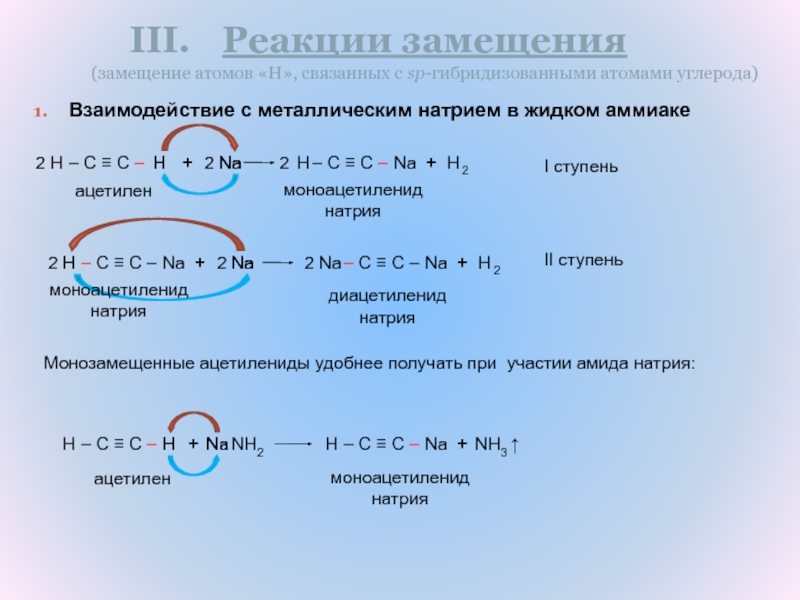
Реакции замещения
(замещение атомов «H», связанных с sp-гибридизованными атомами углерода)
Взаимодействие с
металлическим натрием в жидком аммиаке
– C ≡ C –
H
H
+
Na
– C
≡ C –H
Na
+
2
2
H
2
моноацетиленид натрия
I ступень
ацетилен
– C ≡ C –
H
Na
+
2
2
2
Na
2
Na
– C ≡ C –
Na
+
H
2
II ступень
моноацетиленид натрия
диацетиленид натрия
Монозамещенные ацетилениды удобнее получать при участии амида натрия:
– C ≡ C –
H
H
+
ацетилен
Na
NH2
H
– C ≡ C –
Na
NH3 ↑
+
моноацетиленид натрия
Na
H
Na
H
Na
H
Слайд 6Реакции замещения
(замещение атомов «H», связанных с sp-гибридизованными атомами углерода)
Взаимодействие с
аммиачными растворами солей меди (I) –
только
монозамещенные ацетиленаCH3 – C ≡ C –
H
+
[
Cu
(
NH3
)
]
Cl
2
CH3 – C ≡ C –
Cu
↓
+
H
Cl
+
NH3
2
↑
метилацетилен
метилацетиленид меди (I)
CH3 – C ≡ C – CH3
+
[Cu(NH3)2]Cl
диметилацетилен
Данная реакция используется для очистки высших монозамещенных
алкинов.
Устойчивые во влажном состоянии, эти ацетилениды легко
взрываются в сухом виде!
H
Cu
NH3
Слайд 7Реакции замещения
(замещение атомов «H», связанных с sp-гибридизованными атомами углерода)
Взаимодействие с
аммиачным раствором оксида серебра (I) –
только
монозамещенные ацетиленаCH3 – C ≡ C –
H
+
[
Ag
(
NH3
)
]
OH
2
CH3 – C ≡ C –
Ag
↓
+
H2O
+
NH3
2
↑
метилацетилен
метилацетиленид серебра (I)
CH3 – C ≡ C – CH3
+
[Ag(NH3)2] OH
диметилацетилен
Данная реакция используется для очистки высших монозамещенных
алкинов.
Устойчивые во влажном состоянии, эти ацетилениды легко
взрываются в сухом виде!
H
Ag
NH3
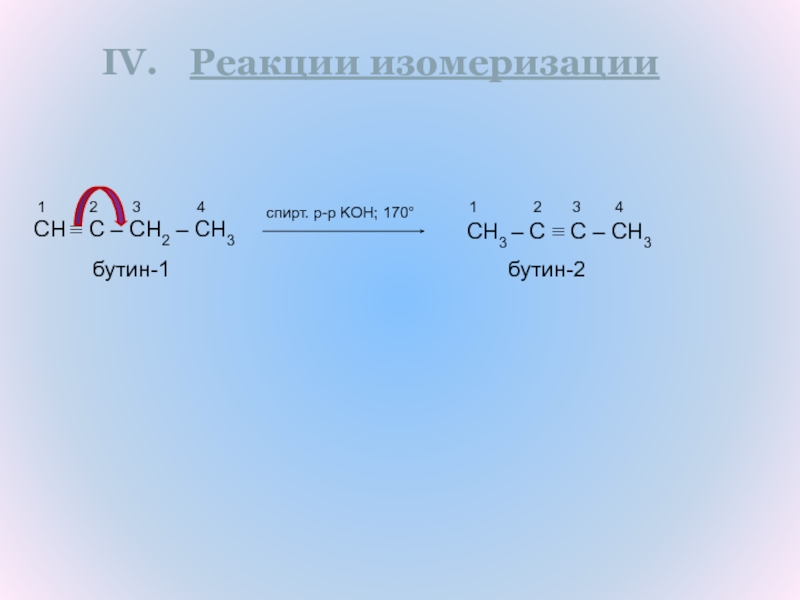
Слайд 8Реакции изомеризации
CH ≡ C – CH2 – CH3
CH3 – C ≡ C – CH3
бутин-2
бутин-1
спирт. р-р KOH; 170°
1 2 3 4
1 2 3 4
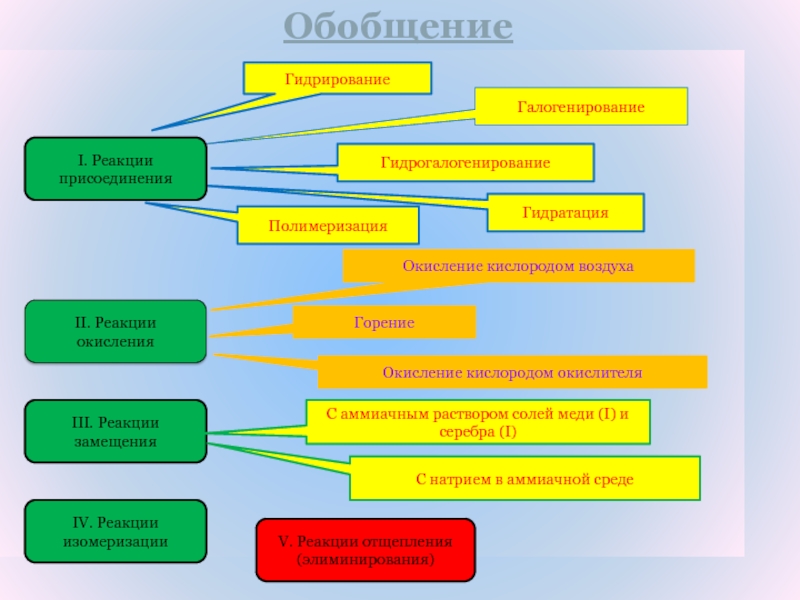
Слайд 9Обобщение
II. Реакции окисления
III. Реакции замещения
IV. Реакции изомеризации
Гидрирование
Галогенирование
Гидрогалогенирование
Гидратация
Полимеризация
Горение
Окисление кислородом воздуха
Окисление
кислородом окислителя
С натрием в аммиачной среде
С аммиачным раствором солей меди
(I) и серебра (I)V. Реакции отщепления (элиминирования)
I. Реакции присоединения
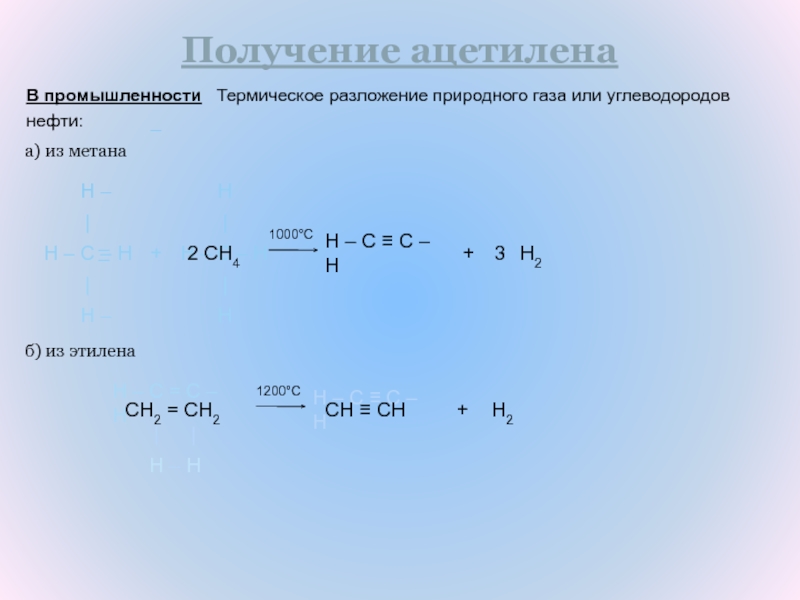
Слайд 10В промышленности Термическое разложение природного газа или углеводородов
нефти:
Получение
ацетилена
H – C –
– C – H
H
|
H
|
H
+
H
1000°C
H –
C ≡ C – H+
3
H2
–
–
–
–
–
H
H
|
|
2 CH4
а) из метана
б) из этилена
1200°C
+
H2
H – C ≡ C – H
H – C = C – H
|
|
H
H
–
–
CH2 = CH2
CH ≡ CH
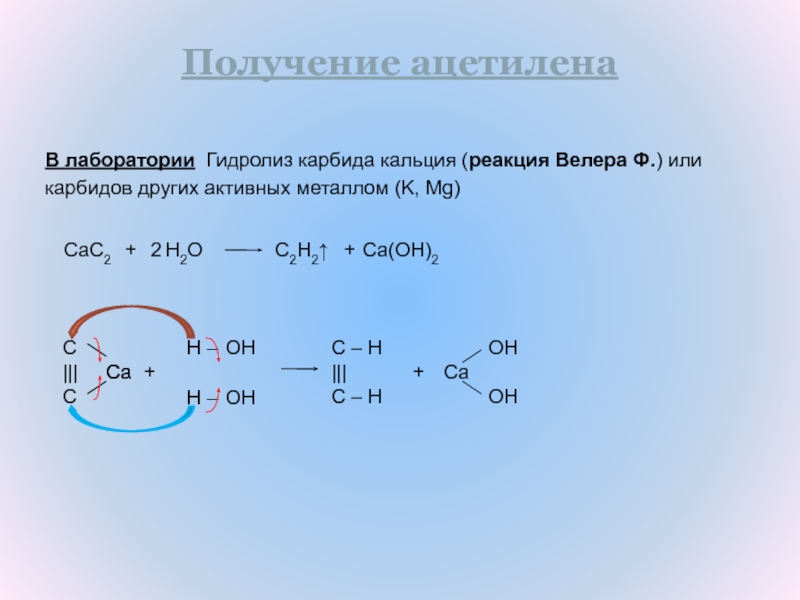
Слайд 11В лаборатории Гидролиз карбида кальция (реакция Велера Ф.) или
карбидов
других активных металлом (K, Mg)
OH
Ca
OHПолучение ацетилена
C2H2↑
CaC2
+
H2O
2
+
Ca(OH)2
C
|||
C
Ca
+
OH
–
H
–
OH
+
–
C – H
|||
C – H
H
–
Ca
H
H
Слайд 12CH3 – CH2 –C – C – CH3
Дегидрогалогенирование дигалогеналканов
действием спиртового раствора
щелочи или твердой щелочи при нагревании (по
правилу Зайцева): при отщеплении галогенводорода от вторичных и третичных галогеналканов атом
водорода отщепляется от наименее гидрированного атома углерода.
Получение гомологов ацетилена
+
H
Br
H
Br
|
|
|
|
Na
OH
–
t°
CH3 – CH2 –C ≡ C – CH3
+
NaBr
2
+
2
H–OH
2,3-дибромпентан
пентин-2
(метилэтилацетилен)
5 4 3 2 1
5 4 3 2 1
Na
Br
OH
H
–
–
Br
–
–
H
Na
OH
–
2
CH3 – CH2 –C – CH
|
|
H
H
Br
Br
|
|
–
+
2
–
–
4 3 2 1
1,1-дибромбутан
–
–
Br
Br
H
H
Na
Na
Na
–
OH
OH
OH
t°
CH3 – CH2 –C ≡ CH
+
2
NaBr
+
2
H–OH
4 3 2 1
бутин-1
(этилацетилен)
–
–
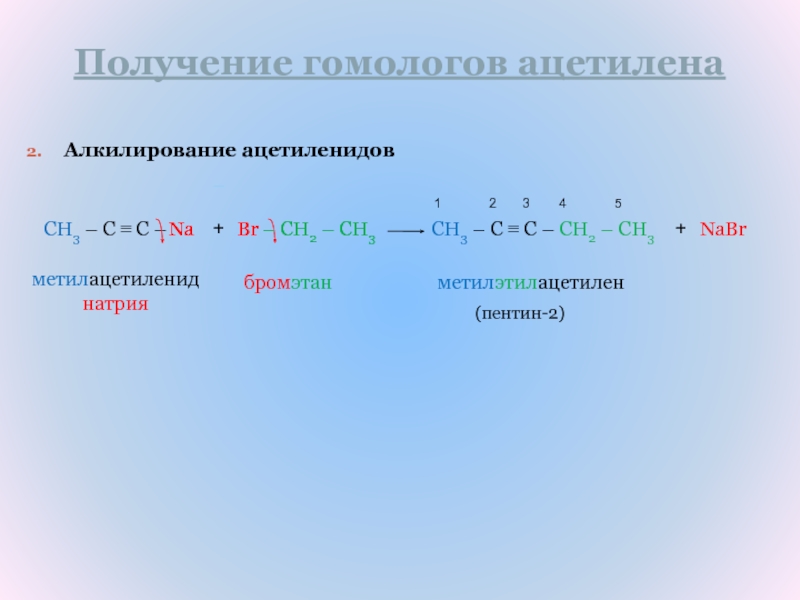
Слайд 13Получение гомологов ацетилена
Алкилирование ацетиленидов
CH3 – C ≡ C –
– CH2
– CH3
Br
Na
+
CH3 – C ≡ C – CH2 – CH3
+
NaBr
1
2 3 4 5метилацетиленид натрия
бромэтан
метилэтилацетилен
(пентин-2)
–
– CH2 – CH3
Br
Na
Слайд 16Используемая литература
«Репетитор по химии (издание 15-ое)», под редакцией Егорова А.
С., Феникс – Ростов-на-Дону, 2006
Габриелян О. С., Маскаев Ф. Н.,
Пономарев С. Ю., Теренин В. И. « Химия 10 класс: профильный уровень». (Учебник для общеобразовательных учреждений), Дрофа – Москва, 2005Рудзитис Г. Е., Фельдман Ф. Г. «Химия 10: органическая химия (Учебник для 10 класса средней школы)», Просвещение – Москва, 1991
Перекалин В. В., Зонис С. А. «Органическая химия (учебное пособие для студентов педагогических институтов по химическим и биологическим специальностям)», Просвещение – Москва, 1982
«Органическая химия. Том1 (Основной курс)» под редакцией Н. А. Тюкавкиной (учебник для студентов вузов по специальности «Фармация»), Дрофа – Москва, 2004


![АЛКИНЫ C2H5CH3C2H5CH3Реакции окисленияИз дизамещенных гомологов ацетилена при окислении образуются соответствующиеR – CC C2H5CH3C2H5CH3Реакции окисленияИз дизамещенных гомологов ацетилена при окислении образуются соответствующиеR – CC – +[O]+H2Oиз KMnO4 O](/img/thumbs/28bf3c95b50a9fababdccedb62e7b73f-800x.jpg)