Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Углерод и его свойства. 9 класс.
Содержание
- 1. Углерод и его свойства. 9 класс.
- 2. Выдающийся французский химик, академик Парижской академии наук.
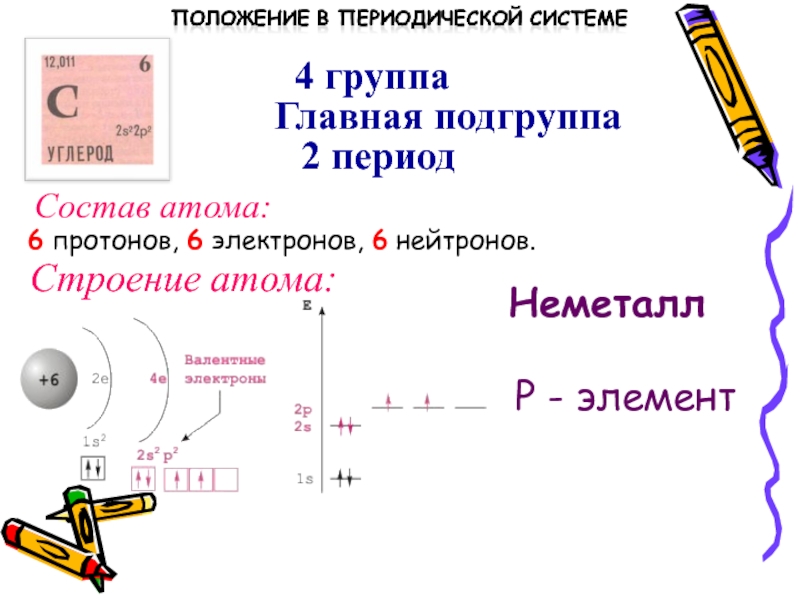
- 3. 4 группаГлавная подгруппа2 периодСостав атома:6 протонов, 6 электронов, 6 нейтронов.Строение атома:НеметаллР - элемент
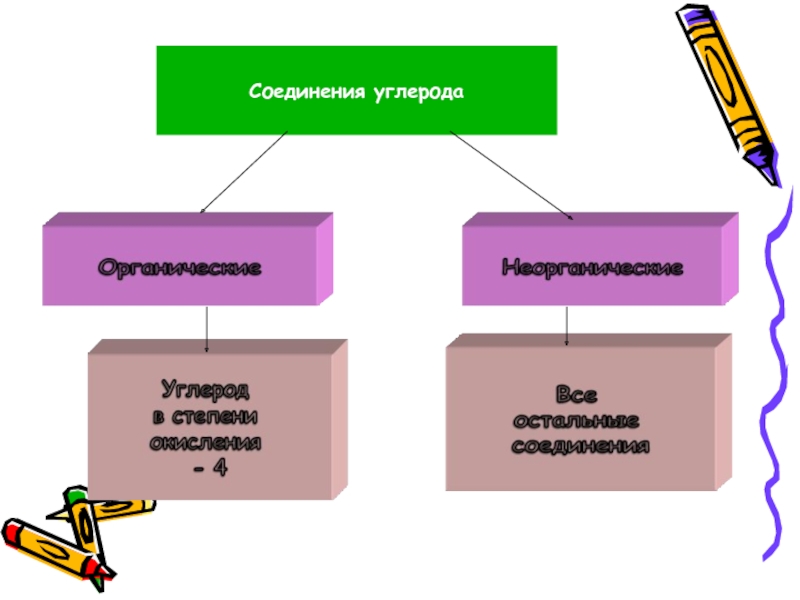
- 4. Соединения углерода
- 5. АЛЛОТРОПИЯ - способность атомов одного химического элемента образовывать несколько простых веществ.?
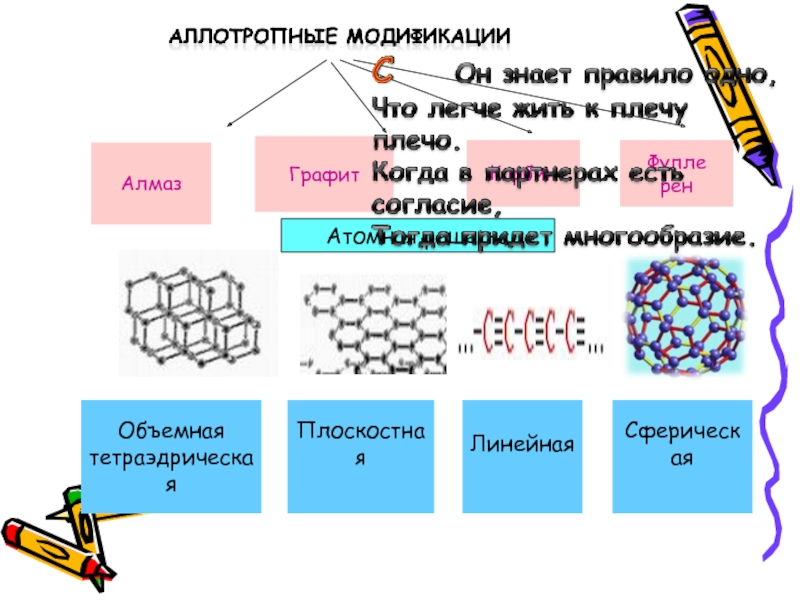
- 6. АлмазГрафитКарбинФуллеренАтомная решеткаОбъемнаятетраэдрическаяПлоскостнаяЛинейнаяСферическая
- 7. АлмазБесцветныйПрозрачныйНе проводит электрический токПрочныйТвердый1772А. ЛавуазьеОн в чистом
- 8. Слайд 8
- 9. Алмаз «ШАХ» 16 век
- 10. Изумруд, бриллианты, золото, серебро
- 11. Бриллианты, сапфир
- 12. Плоский алмаз
- 13. Деталь большой императорской короны
- 14. Алмаз «Орлов»
- 15. ГрафитТемно-серыйНепрозрачныйПроводит электрический токМягкийМеталлический блеск Оставляет след на
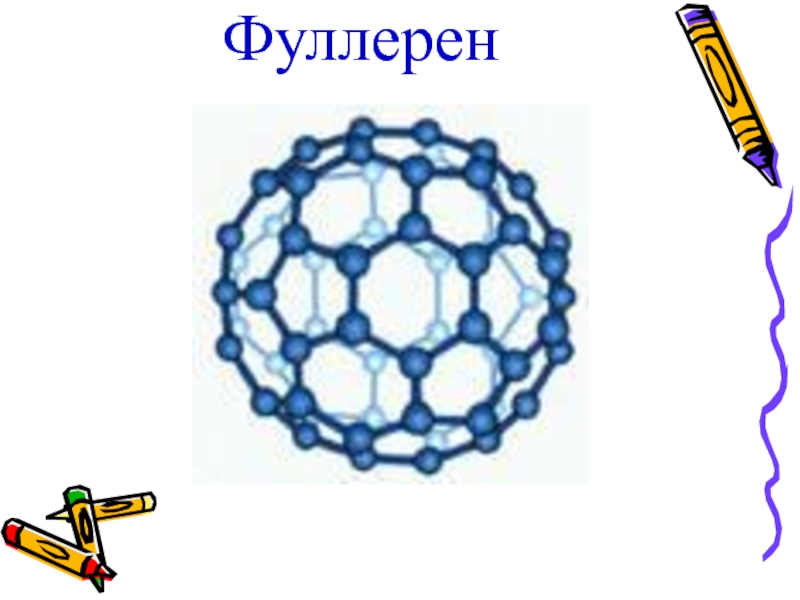
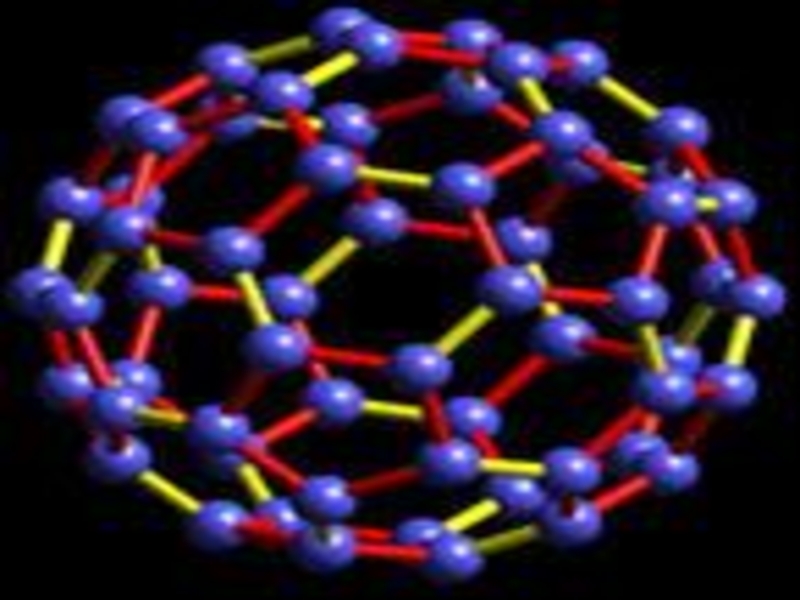
- 16. Фуллерен
- 17. Слайд 17
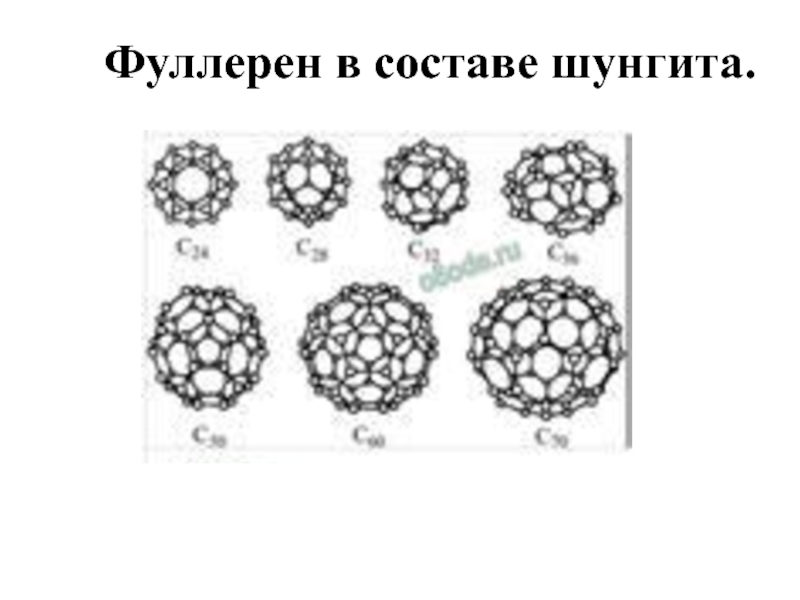
- 18. Фуллерен в составе шунгита.
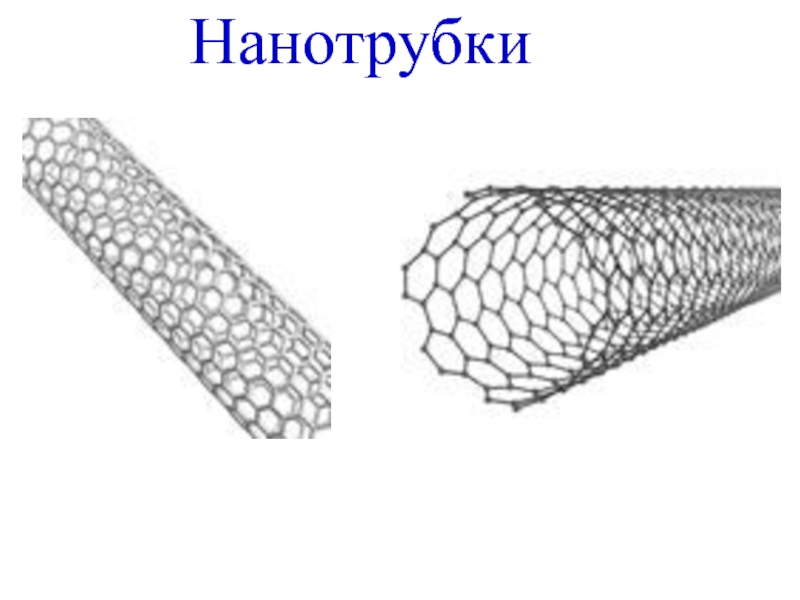
- 19. Нанотрубки
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Многослойная нанотрубка
- 24. - свойство углерода удерживать на пористой поверхности
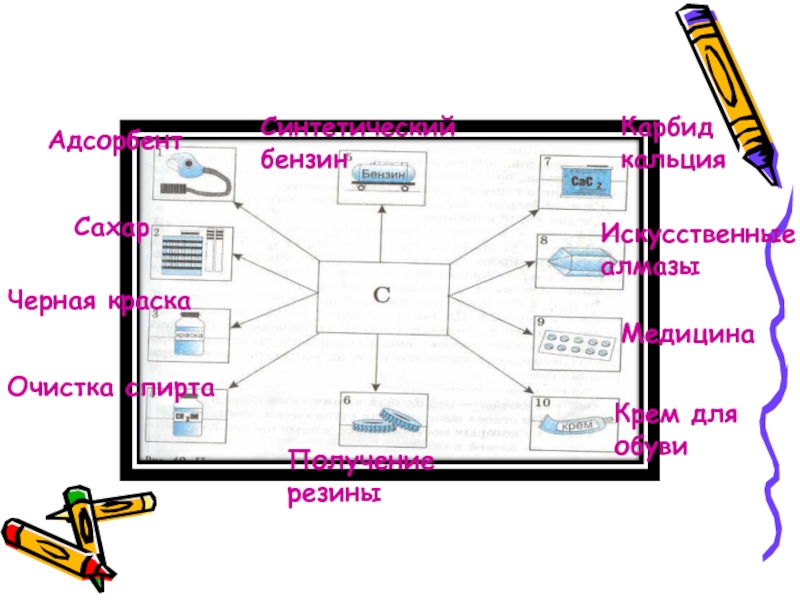
- 25. Применение углеродаАдсорбентСахарЧерная краскаОчистка спиртаСинтетический бензин Получение резиныКарбид кальцияИскусственные алмазыМедицинаКрем для обуви
- 26. Свойства атомов углерода 1. окислительные – атомы С
- 27. При нагревании углерод соединяется с кислородом, образуя
- 28. Горение угля в кислороде
- 29. Слайд 29
- 30. Углерод — сильный восстановитель. При нагревании с
- 31. СМалоактивенНа холодеОкислительВосстановительХИМИЧЕСКИЕСВОЙСТВА+ 4e- 4 eCa + CF2+CO2
- 32. Химические свойства углерода.
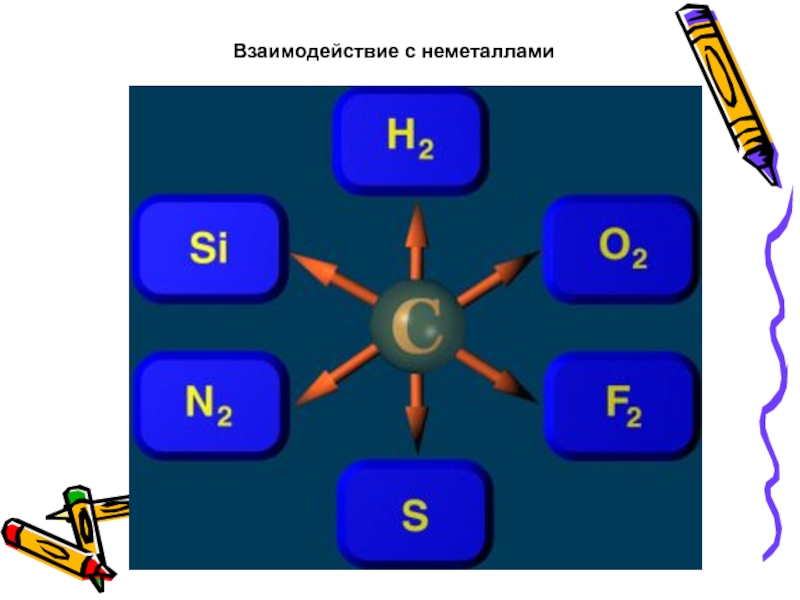
- 33. Взаимодействие с неметаллами
- 34. Слайд 34
- 35. Список использованной литературы:О.С. Габриелян «Химия 9 класс»
- 36. Скачать презентанцию
Выдающийся французский химик, академик Парижской академии наук. В 70-х гг. XVIII в. приступил к решению наиболее важной проблемы химии - изучению процессов горения и дыхания, которые рассматривали тогда с позиции теории
Слайды и текст этой презентации
Слайд 34 группа
Главная подгруппа
2 период
Состав атома:
6 протонов, 6 электронов, 6 нейтронов.
Строение
атома:
Неметалл
Р - элемент
Слайд 5АЛЛОТРОПИЯ - способность атомов одного химического элемента образовывать несколько простых
веществ.
?
Слайд 6Алмаз
Графит
Карбин
Фулле
рен
Атомная решетка
Объемная
тетраэдрическая
Плоскостная
Линейная
Сферическая
Слайд 7Алмаз
Бесцветный
Прозрачный
Не проводит электрический ток
Прочный
Твердый
1772
А. Лавуазье
Он в чистом виде черный, мрачный,
Неплавкий
и едва горюч.
Бывает как кристалл прозрачный,
В котором блещет солнца луч.
О
Б
Л
А
С
Т
И
П
Р
И
М
Е
Н
Е
Н
И
Я
Слайд 15Графит
Темно-серый
Непрозрачный
Проводит электрический ток
Мягкий
Металлический блеск
Оставляет след на бумаге
Жирный на ощупь
1778
К.
В. Шееле
Тот элемент в печной трубе
Находим в виде сажи
Или в
простом карандашеЕго встречаем даже.
О
Б
Л
А
С
Т
И
П
Р
И
М
Е
Н
Е
Н
И
я
Слайд 24- свойство углерода удерживать на пористой поверхности растворенные вещества и
газы
Н. Д. Зелинский
На основе адсорбционных свойств угля разработал фильтрующий противогаз.
Слайд 25Применение углерода
Адсорбент
Сахар
Черная краска
Очистка спирта
Синтетический бензин
Получение резины
Карбид кальция
Искусственные
алмазы
Медицина
Крем для
обуви
Слайд 26Свойства атомов углерода
1. окислительные – атомы С принимают четыре электрона,
приобретают при этом степень окисления -4
2. восстановительные – атомы С
отдают 4 (2) электрона, приобретают при этом степень окисления +4 (+2).Слайд 27При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV),
или углекислый газ:
С + O2 = CO2
При недостатке кислорода образуется
оксид углерода (II), или угарный газ:2С + О2 = 2СО
С водородом углерод соединяется только при высоких температурах и в присутствии катализаторов. В зависимости от температуры образуются различные углеводороды, например, метан:
С + 2H2 = CH4
Углерод взаимодействует при нагревании с серой и фтором, в электрической дуге с азотом:
С + 2S = CS2
С + 2F2 = CF4
2С + N2 = (CN)2
Слайд 30Углерод — сильный восстановитель. При нагревании с водяным паром он
вытесняет из воды водород:
Н2O + С = СО + Н2
При
нагревании углерода с оксидом углерода (IV) образуется угарный газ:С + СО2 = 2СО
Углерод восстанавливает многие металлы из их оксидов:
2Fe2O3 + 3С = 4Fe + 3CO2
С металлами или их оксидами углерод образует карбиды:
CaO + 3C = CaC2 + СО
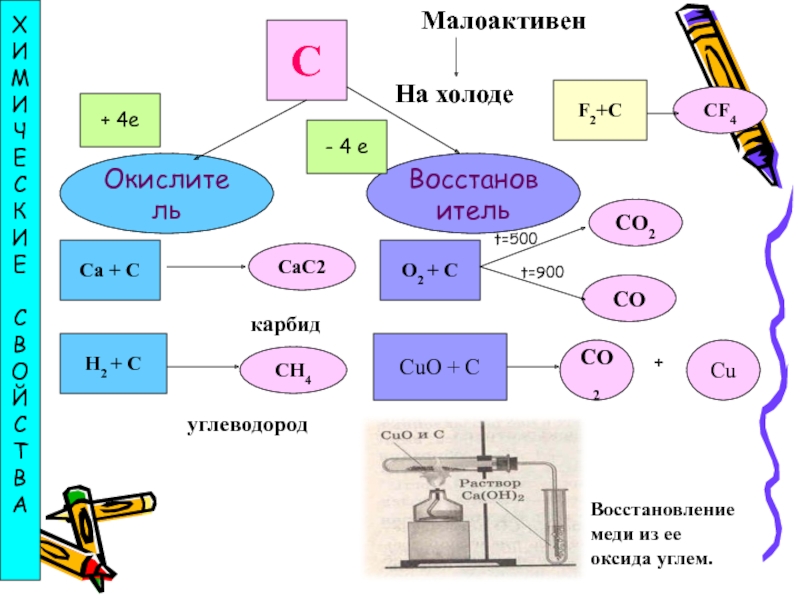
Слайд 31С
Малоактивен
На холоде
Окислитель
Восстановитель
Х
И
М
И
Ч
Е
С
К
И
Е
С
В
О
Й
С
Т
В
А
+ 4e
- 4 e
Ca + C
F2+C
O2 + C
CuO +
C
H2 + C
CaC2
СH4
CF4
CO2
карбид
углеводород
CO
t=500
t=900
CO2
Cu
+
Восстановление
меди из ее
оксида углем.
Слайд 35Список использованной литературы:
О.С. Габриелян «Химия 9 класс» ( М.: Дрофа,
2008), учебник для 9 класса.
О.С. Габриелян «Настольная книга учителя химии.
9 класс», М.: «Блик и К0», 2001 годЭнциклопедия для детей «Аванта +» «Химия», М.: «Аванта +», 2001 год
В. Малышкина «Занимательная химия. Нескучный учебник», Санкт-Петербург, «Тригон», 2001 год.
CD: «Химия–9 («Просвещение»)», мультимедийное учебное пособие нового образца.
Иллюстрации : ресурсы сети Интернет; Большая Советская Энциклопедия, 1978 год.