Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация для урока по теме "Соли" в 8 классе
Содержание
- 1. Презентация для урока по теме "Соли" в 8 классе
- 2. Цель:Обобщить и систематизировать знания о солях, полученные на уроках химии.
- 3. Задачи:Изучить состав, свойства, способы получения, распознавания солей;Изучить
- 4. Соли — это сложные вещества, образованные атомами
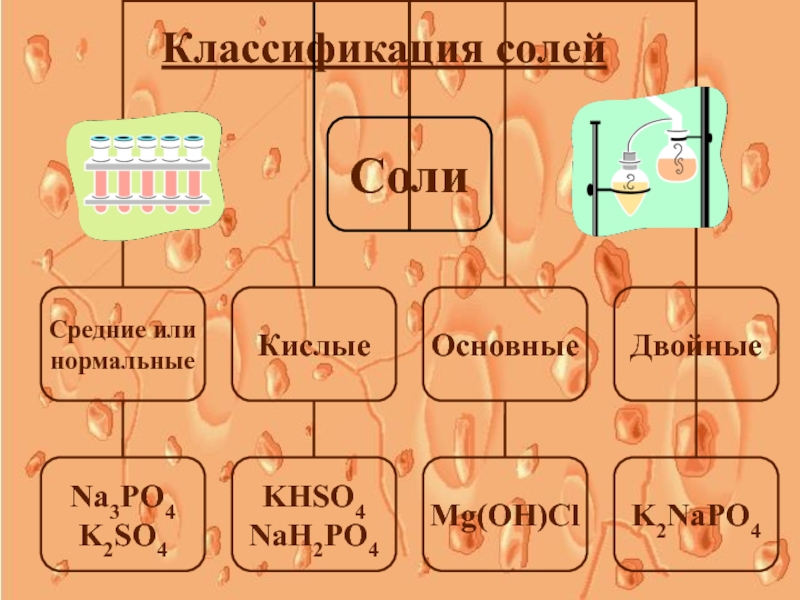
- 5. Классификация солей
- 6. Химические свойства солей1. В водных растворах соли
- 7. 2. В водных растворах соли реагируют со
- 8. Химические свойства солей3. В водных растворах соли
- 9. Химические свойства солей4. В водных растворах соли
- 10. Способы получения солей Соли можно получить, действуя кислотами
- 11. Применение солейСоли серной кислоты — сульфаты: глауберову
- 12. Скачать презентанцию
Цель:Обобщить и систематизировать знания о солях, полученные на уроках химии.
Слайды и текст этой презентации
Слайд 3Задачи:
Изучить состав, свойства, способы получения, распознавания солей;
Изучить области применения и
их значение в жизни организмов;
с солями.Слайд 4Соли — это сложные вещества, образованные атомами металлов и кислотными
остатками.
Состав, представители, номенклатура:
NaCl — хлорид натрия,
Na2SO4 — сульфат натрия,
Na2CO3 —
карбонат натрия,Na3PO4 — фосфат натрия,
NaNO3 — нитрат натрия.
Средние соли — это сложные вещества, которые в водных растворах диссоциируют на положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков.
Например: NaCl Na++Cl-
Определение солей
Слайд 6Химические свойства солей
1. В водных растворах соли реагируют с кислотами
с образованием соли и кислоты.
BaCl2+H2SO4=BaSO4 +2HCl
Ионные уравнения:
Ba2++2Cl-+2H++SO2-4=BaSO4 +2H++2Cl-
Ba2++SO2-4=BaSO4
Слайд 72. В водных растворах соли реагируют со щелочами с образованием
соли и основания, например:
а) нерастворимой соли:
Na2CO3+Ca(OH)2=CaCO3 +2NaOH
Ионные уравнения:
2Na++CO2-3+Ca2++2OH-=CaCO3 +2Na++2OH-
Ca2++CO2-3=CaCO3
Химические свойства
солейСлайд 8Химические свойства солей
3. В водных растворах соли реагируют между собой
с образованием двух солей:
Pb(NO3)2+K2SO4=PbSO4 +2KNO3
Ионные уравнения:
Pb2++2NO3-+2K++SO2-4=PbSO4 +2K++2NO3-
Pb2++SO2-4=PbSO4
Слайд 9Химические свойства солей
4. В водных растворах соли взаимодействуют с металлами:
Fe+CuSO4
FeSO4+Cu
Fe0+Cu2++SO2-1 Fe2++SO2-4+Cu0
Fe0+Cu2+ Fe2++Cu0
Слайд 10Способы получения солей
Соли можно получить, действуя кислотами на металлы, основные
оксиды и основания:
2H3PO4+6Na 2Na3PO4+3H2
ортофосфат натрия3H2SO4+Fe2O3 Fe2(SO4)3+3H2O
сульфат железа (III)
3HNO3+Cr(OH)3 Cr(NO3)3+3H2O
нитрат хрома (III)
Слайд 11Применение солей
Соли серной кислоты — сульфаты: глауберову соль Na2SO4∙10H2O применяют
при производстве стекла, в медицине.
CaSO4∙2H2O — природный гипс — применяют
в медицине и строительстве.Соли стронция окрашивают пламя в красный цвет, меди в голубой или зеленый, натрия — в желтый, калия — в фиолетовый, поэтому используются для изготовления фейерверков.
Соли азотной кислоты — нитраты — используются в качестве минеральных удобрений, это KNO3— калийная селитра, NaNO3 — натриева селитра — для получения взрывчатых веществ, красителей и лекарств, соединения фосфорной кислоты используются для создания дымовых завес.
CaCO3 — карбонат кальция, мел, мрамор — в строительстве, в производстве чугуна.
NaHCO3 — гидрокарбонат натрия, питьевая сода — в кондитерской промышленности, в медицине для полоскания горла, для оказания первой помощи при ожогах кислотами.