Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение
Содержание
- 1. Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение
- 2. Определи свое эмоциональное состояние
- 3. Создать условия для изучения
- 4. Простые и сложные вещества;Классификация и номенклатура;Оксиды;Основания;Кислоты;Соли.Основные понятия:
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Кислород, спрятанный в камне
- 10. «Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение»
- 11. Демонстрационный эксперимент: «Образцы оксидов»
- 12. Оксиды;Состав;Классификация;Номенклатура;Свойства;Получение;Применение.Основные понятия:
- 13. (окисел, окись) — бинарное соединение химического
- 14. Номенклатура оксидов:Слово «оксид»+Название элементаУказание валентности (в скобках)*+*
- 15. 1. Солеобразующие:Основной оксид (МеО - Wме –
- 16. Оксид серы (IV);Оксид калия;Оксид алюминия;Оксид железа (II);Оксид
- 17. Оксид серы (IV) – SO2 - кислотный
- 18. Химичим от души, но не забываем о технике безопасности!
- 19. Задания по группам – лабораторный опыт1 ряд
- 20. 1. ... + H2O
- 21. ... + H2O → HR (р) ...
- 22. ... + HR (р) → MeR
- 23. 1. Рассмотреть химические свойства: 1 ряд
- 24. Оксиды- это вещества реальные или виртуальные?
- 25. Непосредственное соединение простого вещества с кислородом;Горение сложных
- 26. 1. Непосредственное соединение простого вещества с кислородом (демонстрационый эксперимент): Получение оксидов:
- 27. 2. Горение сложных веществ (демонстрационный эксперимент):Этанол + кислород → оксид углерода (IV) + оксид водорода;
- 28. 3. Разложение при нагревании кислородных соединений: карбонатов,
- 29. Самоконтроль и самокоррекция
- 30. 1. Сложные вещества делят на …;2.
- 31. 1. Оксиды – сложные вещества, состоящие из
- 32. 1. Оксиды – сложные вещества, состоящие из
- 33. 1. Литий, вода, натрий, алюминий;2. Фосфор, сера,
- 34. 1. Fe(OH)2; Cu(OH)2; NaOH; Zn(OH)2; 2. Na2O;
- 35. HCl, K2O,
- 36. 1. Бромид железа (III);2. Сульфат марганца (II);3.
- 37. - Знаю – - Узнал – - Хочу узнать –Рефлексия
- 38. Определи свое эмоциональное состояние
- 39. 1. Я познаю мир: Детская энциклопедия: Химия/
- 40. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1 Классы неорганических соединений
Кучеева Татьяна Николаевна,
учитель химии ОГАОУ
«Белгородский инженерный юношеский лицей-интернат»
Слайд 3 Создать условия для изучения классификации неорганических
веществ и самостоятельному применению знаний в сходной и новой ситуациях.
Дидактическая цель:
Слайд 4Простые и сложные вещества;
Классификация и номенклатура;
Оксиды;
Основания;
Кислоты;
Соли.
Основные понятия:
Слайд 13 (окисел, окись) — бинарное соединение химического элемента с кислородом
в степени окисления −2, в котором сам кислород связан только
с менее электроотрицательным элементом.
Оксиды-
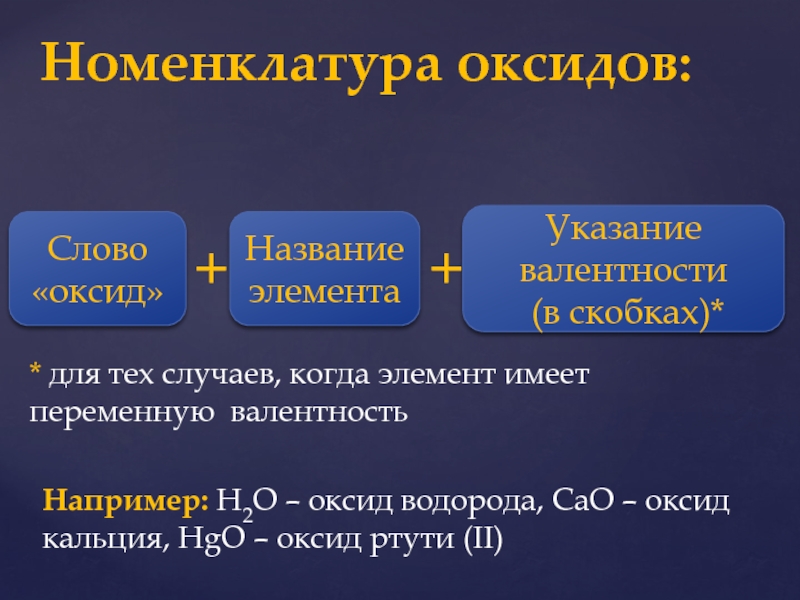
Слайд 14Номенклатура оксидов:
Слово
«оксид»
+
Название элемента
Указание валентности
(в скобках)*
+
* для тех случаев,
когда элемент имеет переменную валентность
Например: Н2О – оксид
водорода, СаО – оксид кальция, HgО – оксид ртути (II) Слайд 151. Солеобразующие:
Основной оксид (МеО - Wме – I, II)
Амфотерный оксид
(МеО - Wме – III – исключение оксид бериллия, оксид
цинка, оксид марганца (IV))Кислотный оксид (МеО, неМеО – W ≥ IV)
2. Несолеобразующие (безразличные):
неМеО - WнеМе ≤ IV
Типы оксидов:
Слайд 16Оксид серы (IV);
Оксид калия;
Оксид алюминия;
Оксид железа (II);
Оксид железа (III);
Оксид марганца
(VII);
Оксид серебра.
Составьте формулы и определите тип оксида:
Слайд 17Оксид серы (IV) – SO2 - кислотный ;
Оксид калия –
K2O - основной;
Оксид алюминия – Al2O3 - амфотерный;
Оксид железа (II)
– FeO - основной;Оксид железа (III) – Fe2O3 - амфотерный;
Оксид марганца (VII) – Mn2O7 - кислотный;
Оксид серебра – Ag2O - основной.
Составьте формулы и определите тип оксида:
Слайд 19Задания по группам – лабораторный опыт
1 ряд - «Химические свойства
основных оксидов»;
2 ряд - «Химические свойства кислотных оксидов» ;
3
ряд -«Химические свойства амфотерных оксидов»Слайд 20 1. ... + H2O → МеОН (р)
2. ... + HR → MeR + H2O
3. ... + кислотный оксид → MeR Лабораторный опыт: «Химические свойства основных оксидов»
Слайд 21... + H2O → HR (р)
... + MeOH(р) →
MeR + H2O
... + основной оксид → MeR
Лабораторный
опыт: «Химические свойства кислотных оксидов»Слайд 22 ... + HR (р) → MeR + H2O
...
+ MeOH(р) → MeR + H2O
Лабораторный опыт:
«Химические свойства амфотер-
ных оксидов»Слайд 231. Рассмотреть химические свойства:
1 ряд – оксид лития;
2 ряд – оксид азота (IV);
3 ряд
– оксид цинка.2. Составьте рассказ о происхождении данных оксидов.
3. Осуществите превращение:
литий → оксид лития → гидроксид лития → ортофосфат лития
Домашнее задание:
Слайд 25Непосредственное соединение простого вещества с кислородом;
Горение сложных веществ;
Разложение при нагревании
кислородных соединений: карбонатов, нитратов, нерастворимых оснований.
Получение оксидов:
Слайд 261. Непосредственное соединение простого вещества с кислородом (демонстрационый эксперимент):
Получение
оксидов:
Слайд 272. Горение сложных веществ (демонстрационный эксперимент):
Этанол + кислород → оксид
углерода (IV) + оксид водорода;
Слайд 283. Разложение при нагревании кислородных соединений: карбонатов, нитратов, нерастворимых оснований:
Нитрат
меди (II) → оксид меди (II) + оксид азота (IV)
+ кислород;Гидроксид железа (III) → оксид железа (III) + вода.
Слайд 301. Сложные вещества делят на …;
2. Основной оксид
- …;
3. Кислотный оксид - …;
4. Основания –
это сложные вещества, состоящие из …;5. Кислоты – это сложные вещества, состоящие из …;
6. Соли – это сложные вещества, состоящие из …
Продолжите предложение:
Слайд 311. Оксиды – сложные вещества, состоящие из двух элементов, один
из которых кислород;
2. Неметаллы обладают металлическим блеском;
3. Оксид серы (IV)
– кислотный оксид;4. Оксид натрия – кислотный оксид;
5. Реакция обмена – реакция между основанием и кислотой.
Верно ли утверждение, что:
(физкультминутка)
Слайд 321. Оксиды – сложные вещества, состоящие из двух элементов, один
из которых кислород;
2. Неметаллы обладают металлическим блеском;
3. Оксид серы (IV)
– кислотный оксид;4. Оксид натрия – кислотный оксид;
5. Реакция обмена – реакция между основанием и кислотой.
Верно ли утверждение, что:
Слайд 331. Литий, вода, натрий, алюминий;
2. Фосфор, сера, кремний, железо;
3. Оксид
бария, оксид фосфора (V),
оксид азота (IV), оксид серы (IV);
4. Серная
кислота, сернистая кислота, фосфорная кислота, угольная кислота;5. Гидроксид калия, гидроксид кальция, гидроксид лития, гидроксид натрия.
Укажите лишнее:
Слайд 34
1. Fe(OH)2; Cu(OH)2; NaOH; Zn(OH)2;
2. Na2O; BeO; CaO; CuO;
3.
H2SO4; HClO4; H2S; H2CO3;
4. Na2SO4; KCl; HF; KNO3.
Укажите лишнее:
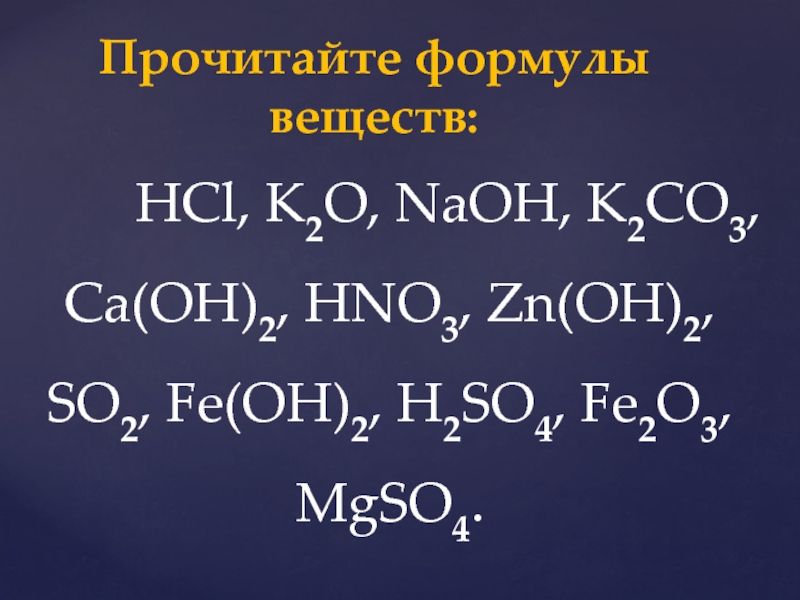
Слайд 35 HCl, K2O, NaOH, K2CO3, Ca(OH)2,
HNO3, Zn(OH)2, SO2, Fe(OH)2, H2SO4, Fe2O3, MgSO4.
Прочитайте формулы веществ:
Слайд 361. Бромид железа (III);
2. Сульфат марганца (II);
3. Гидросульфид натрия;
4. Дихромовая
кислота;
5. Нитрат меди (II);
6. Азотистая кислота;
7. Иодид бария;
8. Дигидрофосфат железа
(III);9. Гидрокарбонат кальция;
10. Сульфат натрия.
Составьте формулы веществ:
Слайд 391. Я познаю мир: Детская энциклопедия: Химия/ Авт.-сост. Л. А.
Савина; Худож. А. В. Карадашук, О. М. Войтенко. – М.:
ООО «Издательство АСТ-ЛТД», 1998. – 448 с.2. Кузнецова Н. Е., Титова И. М., Гара Н. Н., Жегин А. Ю. Химия. Учебник для учащихся 8 класса общеобразовательных учреждений. – М.: «Вентана-Граф», 1997. – 336 с.
3. Рудзитис Г. Е. Химия: неорган. химия: учеб. для 8 кл. общеобразоват. учреждений/ Г. Е. Рудзитис, Ф. Г. Фельдман. – 12-е изд. испр. – М.: Просвещение, 2008. – 176 с.
4. Полный комплект цветных таблиц по неорганической химии. Весь курс средней школы 100 таблиц формата А1. Авторы: Назарова Т.С., Куприянова Н.С., Кожевников Д.Н., Назарова А.Г.
5. Лидин Р. А. Задачи, вопросы и упражнения по химии: 8 – 11 кл.: Пособие для учащихся общеобразоват. учреждений/ Р. А. Лидин, Л. Ю. Аликберова. – М.: просвещение, 2002. – 189 с.
http://www.ekko.com.ua/img/gor1.jpg
http://atf-bntu.narod.ru/articles/generator.html
Литература