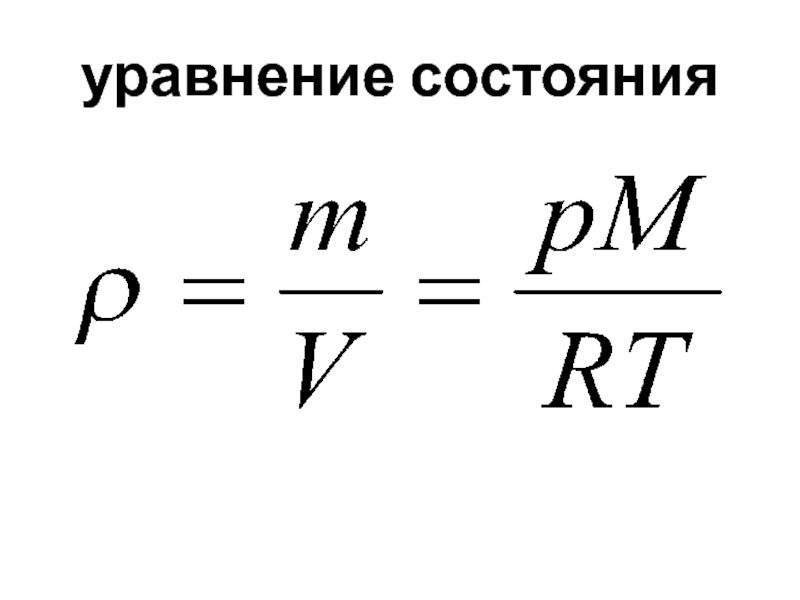Слайд 1Основы биоэнергетики.
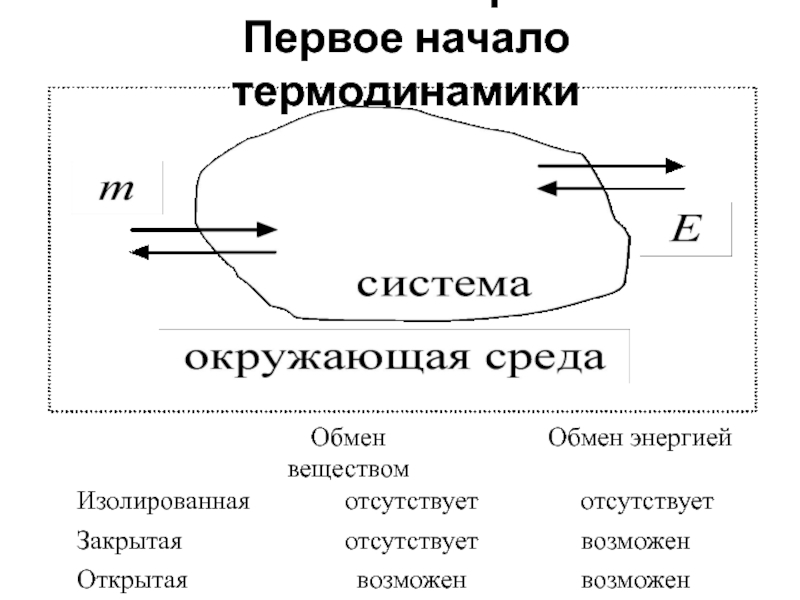
Первое начало термодинамики
Слайд 2Характеристики системы
Параметры состояния системы – физические величины, определяющие термодинамические свойства
системы
Интенсивные параметры – величины, значения которых не зависят от
массы системы. К ним относятся: температура (T), давление (p), концентрация (c), плотность (ρ) и другие. В пределах одной фазы интенсивные параметры остаются постоянными или изменяются непрерывно, а при переходе через фазовую границу – скачкообразно. При взаимодействии двух и более систем значения их интенсивных параметров усредняются.
Экстенсивные параметры – величины, значения которых зависят (пропорциональны) массе; к ним относятся: объем (V), количество вещества (ν), внутренняя энергия (U), энтальпия (H) и другие. Значения экстенсивных параметров системы равны сумме параметров всех частей системы. При взаимодействии систем их экстенсивные параметры суммируются. После отнесения к единице массы (удельные величины) или к единице количества вещества (мольные величины) экстенсивные параметры приобретают свойства интенсивных!
Слайд 3Характеристики системы
Функции состояния – функции независимых параметров, изменения которых в
ходе процесса не зависят от пути процесса, а определяются только
начальным и конечным состоянием системы.
Уравнения, связывающие функции состояния и независимые переменные, называются уравнениями состояния. Функциональные зависимости определяются на основе законов (начал) термодинамики.
Слайд 5состояния системы
Равновесное состояние системы предполагает постоянство ее параметров во времени.
Такое постоянство может достигаться по-разному:
при отсутствии потоков вещества и
энергии через систему. Такое состояние не предполагает внесения в систему других веществ или изменение ее энергии и называется состоянием термодинамического равновесия.
Равновесное состояние, при котором имеются потоки вещества и энергии, называется стационарным состоянием.
Равновесное состояние, достигаемое при равенстве скоростей противоположно направленных химических процессов называется состоянием химического равновесия.
Слайд 6Термодинамические процессы
Переход системы из одного состояния в другое называется процессом
классификация процессов:
по постоянству независимых параметров на изотермические (идут при постоянной
температуре T = const), изобарные (при постоянном давлении p = const) изохорные (при постоянном объеме V = const), адиабатические, протекающие без теплообмена с окружающей средой (Q = const).
Слайд 7Термодинамические процессы
по энергозатратам – на самопроизвольные и несамопроизвольные.
Самопроизвольные процессы –
это процессы, не требующие воздействий на систему, связанных с передачей
ей энергии в форме работы;
Несамопроизвольные процессы – это процессы, происходящие только при условии подвода к системе энергии извне.
Слайд 8Внутренняя энергия
внутренняя энергия (U), представляет собой сумму всех видов энергий
составных частей системы, таких как кинетическая энергия хаотического движения частиц,
межмолекулярная, внутриатомная и внутриядерная энергии, энергия связей, гравитационная энергия и т.д. Количество внутренней энергии зависит от состава, состояния системы.
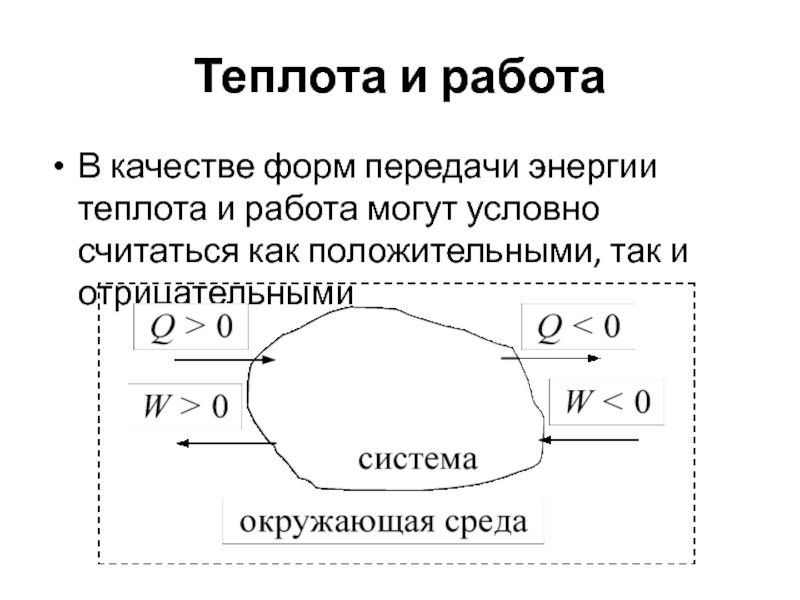
Слайд 9Теплота и работа
Это формы передачи энергии.
Теплота – неупорядоченная передача
энергии в результате контакта движущихся микрочастиц.
Работа – упорядоченная передача
энергии, связанная с преодолением внешнего сопротивления
Слайд 10Теплота и работа
В качестве форм передачи энергии теплота и работа
могут условно считаться как положительными, так и отрицательными
Слайд 11первое начало термодинамики
В любом процессе сумма теплоты и
работы равна изменению запаса энергии системы.
ΔU = Q –
W,
Слайд 12энтальпия
QV = Qp + p · ΔV
где QV и Qp – теплота изохорного и изобарного
процессов
−Qp = − QV + p·ΔV = ΔU + p·ΔV = ΔH энтальпия это функция состояния системы, изменение которой равно теплоте необратимого изобарно-изотермического процесса.
H = U + p·V
Изменение энтальпии:
ΔH = ΔU + p·ΔV
Слайд 13энтальпия
Тепловой эффект реакции при условии p = const
называется энтальпией реакции (обозначение ΔrH). В термодинамической системе знаков тепловой
эффект считается отрицательным (ΔrH < 0) при выделении теплоты и положительным (ΔrH > 0) – при ее поглощении.
Слайд 14Стандартные условия
Стандартные условия – давление 101325 Па, если вещества
находятся в чистом кристаллическом состоянии, или по 101325 Па для
каждого компонента газовой смеси и по 1 моль/л каждого компонента в растворе. Все справочные данные также относятся к стандартной температуре 298,15 К. Стандартные условия обозначаются верхним индексом "°" при символе термодинамической характеристики, например, ΔH°298.
Слайд 15
Стандартная энтальпия образования вещества (ΔfH°) – теплота (при p =
const), выделяющаяся или поглощающаяся при образовании 1 моль данного вещества
из простых веществ, находящихся в стандартном состоянии.
6C (графит) + 6H2 (г)+ 3O2 (г)→ C6H12O6 (тв) ΔfH°
Слайд 16
Стандартная энтальпия сгорания вещества ΔсH° - теплота (при p =
const), которая выделяется в реакции сгорания 1 моль данного вещества
в избытке кислорода. Необходимо учитывать, что конечными продуктами горения органических соединений являются газы: CO2, H2O, SO2, N2, HHal (галогеноводороды).
Слайд 17термохимия
Раздел химической термодинамики, изучающий тепловые эффекты химических реакций, теплоемкости веществ
и теплоты фазовых переходов, а также их зависимости от различных
физико-химических параметров, называется термохимия.
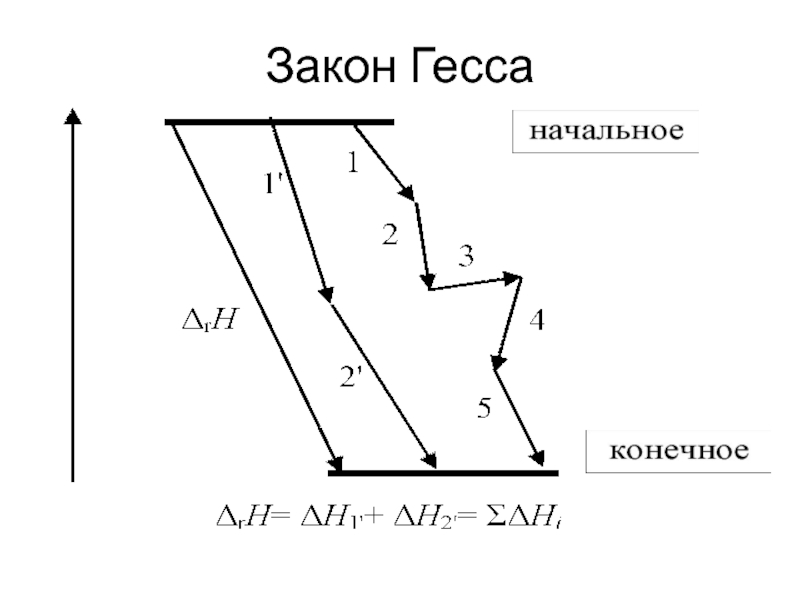
Слайд 18Закон Гесса
изменение энтальпии в ходе реакции при постоянстве
температуры и давления зависит только от вида и состояния исходных
веществ и продуктов реакции и не зависит от пути превращения
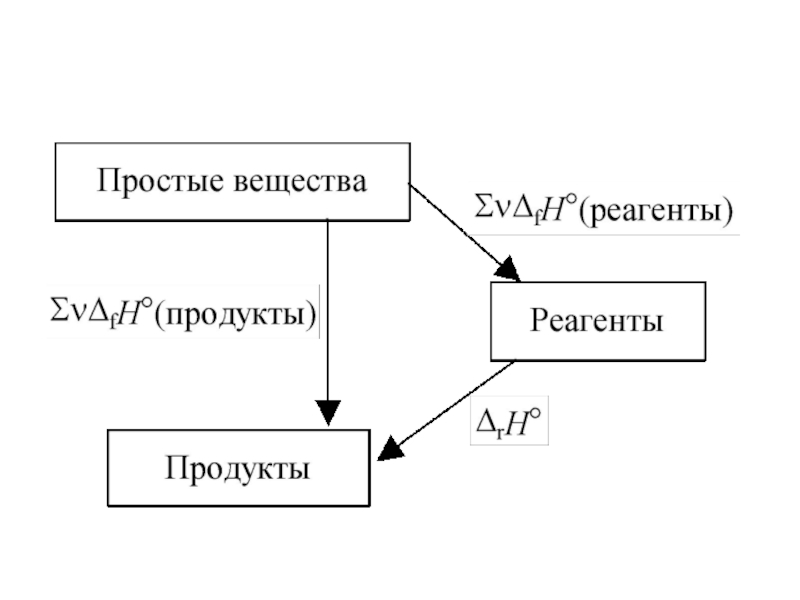
Слайд 20Следствия закона Гесса
энтальпия реакции равна разности сумм энтальпий образования продуктов
реакции и энтальпий образования исходных веществ:
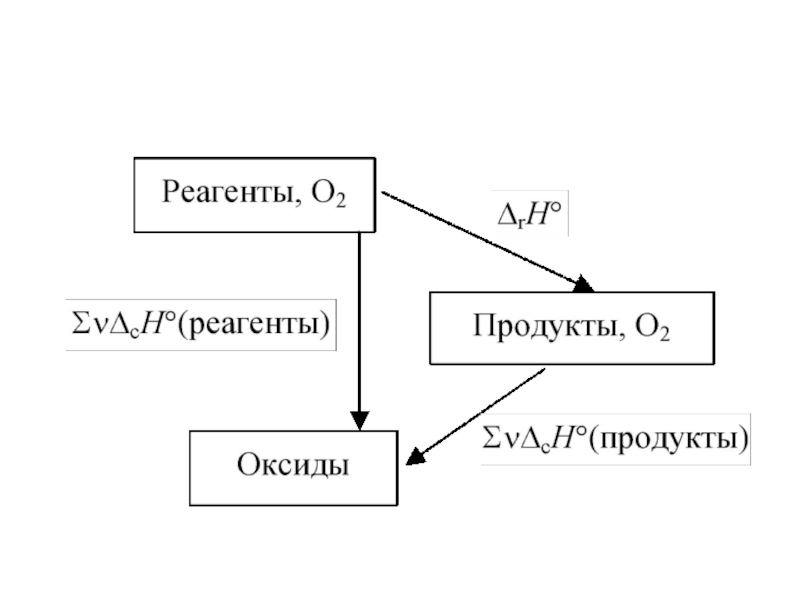
Слайд 21Следствия закона Гесса
энтальпия разложения химического соединения равна, но противоположна по
знаку, энтальпии его образования из тех же продуктов разложения, находящихся
в том же состоянии и при тех же условиях, т.е.
ΔrH(прямой реакции) = ΔrH°(обратной реакции)
Следовательно
Слайд 24
Пример. Рассчитайте стандартную теплоту реакции
2H2S(г) + 6NO(г) = 2H2O(ж)
+ 2SO2(г) + 3N2(г).
(записываем под формулами веществ значения ΔfH° из
таблицы)
ΔfH°, кДж/моль
−20,5 -90 −286 −297 0
Вычислим ΔrH°:
ΔrH° = [2(−286) + 2(−297)] − [2(−20,5) + 6⋅90] = −1665 кДж/моль.