Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительно-восстановительные реакции 8 класс
Содержание
- 1. Окислительно-восстановительные реакции 8 класс
- 2. «Чтобы что-то узнать,
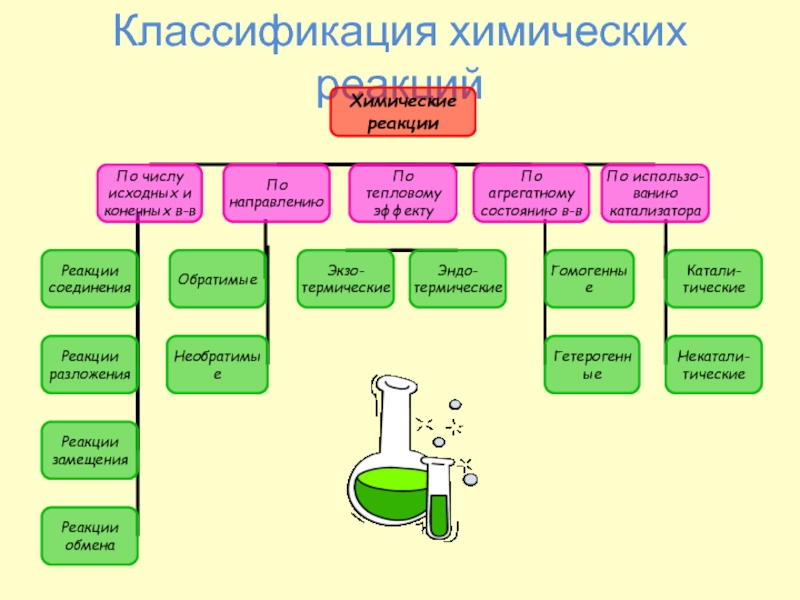
- 3. Классификация химических реакций
- 4. Дайте характеристику реакциям по всем известным признакам
- 5. Тема урока: «Окислительно-восстановительные реакции»
- 6. Определите степень окисления элементов в веществах, формулы
- 7. Лабораторный опыт Проведите реакции
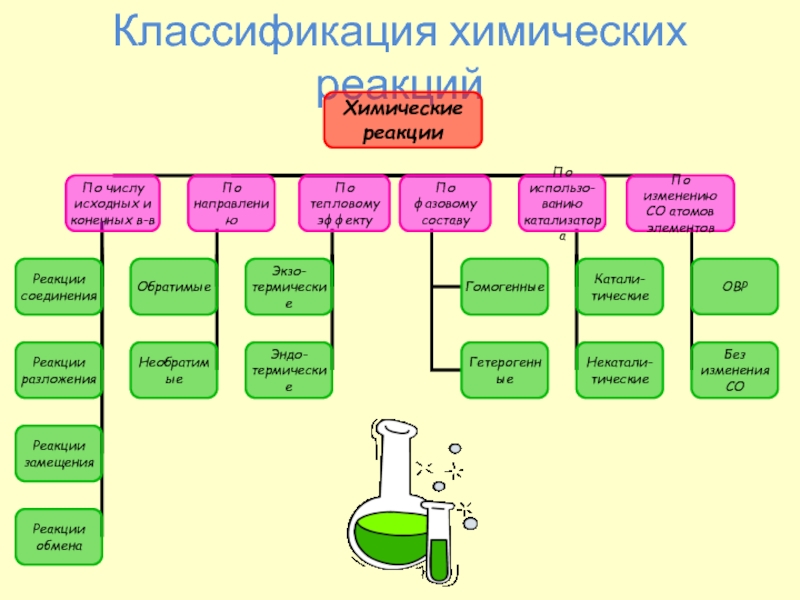
- 8. Классификация химических реакций
- 9. ОВР
- 10. «Окислитель как отъявленный злодей,Как пират, бандит, агрессор,
- 11. Какие из приведенных схем
- 12. Вывод:К окислительно-восстановительным реакциям относятся: все реакции замещения;
- 13. Многообразие окислительно-восстановительных реакций
- 14. Тестовое задание Задание
- 15. Тестовое заданиеЗадание № 2.I вариантВ каком соединении
- 16. Тестовое заданиеЗадание № 3.I вариантСхема Na0
- 17. Тестовое заданиеЗадание № 4.I вариантВосстановительные свойства простых
- 18. Ответы I вариант1 - В2
- 19. Слайд 19
- 20. Скачать презентанцию
Слайды и текст этой презентации
Слайд 4Дайте характеристику реакциям по всем известным признакам классификации.
t,MnO2
2КClO3(т)
→ 2KCl(т) + 3O2(г)↑ - Q2NO(г) + O2(г) ⇄ 2NO2(г) + Q
C(т) + CO2(г) ⇄ 2CO(г) - Q
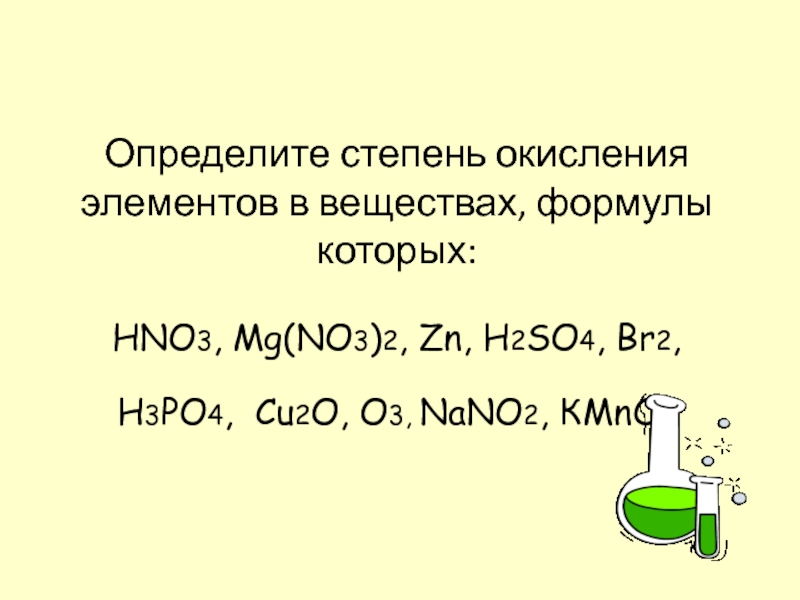
Слайд 6Определите степень окисления элементов в веществах, формулы которых:
HNO3, Mg(NO3)2, Zn, H2SO4,
Br2,H3PO4, Cu2O, O3, NaNO2, КMnO4
Слайд 7Лабораторный опыт
Проведите реакции между раствором сульфата
меди (II) и:
раствором гидроксида натрия,
железной кнопкой.
Укажите
признаки химических реакций, запишите молекулярные
уравнения и определите
степень окисления
каждого элемента.
Слайд 9 ОВР – это такие
реакции, при которых
происходит изменение СО элементов.Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
Атомы, молекулы или ионы, отдающие электроны, являются восстановителями.
Атомы, молекулы или ионы,
присоединяющие электроны, называются окислителями.
Слайд 10«Окислитель
как отъявленный злодей,
Как пират, бандит, агрессор,
Бармалей,
Отнимает электроны - и ОК!
Потерпев урон, восстановитель
Восклицает: «Вот я, помогите!
Электроны
мне мои верните!»…Но никто не помогает и ущерб
Не возмещает…»
Запомните!
Отдать электроны – окислиться,
взять электроны – восстановиться
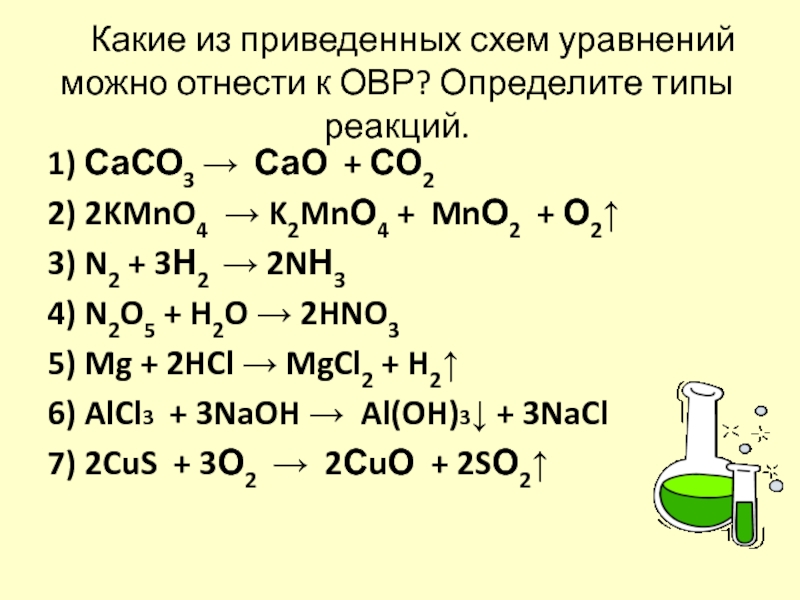
Слайд 11 Какие из приведенных схем уравнений можно отнести
к ОВР? Определите типы реакций.
1) СаСО3 → СаО + СО2
2)
2KMnO4 → K2MnО4 + MnО2 + О2↑3) N2 + 3Н2 → 2NН3
4) N2O5 + H2O → 2HNO3
5) Mg + 2HCl → MgCl2 + H2↑
6) AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
7) 2CuS + 3О2 → 2СuО + 2SО2↑
Слайд 12Вывод:
К окислительно-восстановительным реакциям относятся:
все реакции замещения;
только те реакции
соединения и разложения,
в которых участвует хотя бы
одно простое вещество;
реакции горения.
Все реакции ионного обмена не будут являться окислительно-восстановительными!
Слайд 14Тестовое задание
Задание № 1.
I вариант
К ОВР не относится
реакция, представленная
схемой:А) N2 + 3Н2 → 2NН3
Б) Mg + 2HCl → MgCl2 + H2↑
В) MgCO3 → MgO + CO2 ↑
Г) 2CuO → 2Cu + O2↑
Задание № 1.
II вариант
К ОВР относится реакция, представленная схемой:
А) H2O + CaO → Ca(OH)2
Б) H2O + N2O5 → 2HNO3
В) Na2CO3 +2HCl →2NaCl+ H2O+CO2
Г) CuO + H2 → Cu + H2O
Слайд 15Тестовое задание
Задание № 2.
I вариант
В каком соединении
степени окисления
элементов
равны -3 и +1
А) NF3
Б) Cl2O3
В) NH3
Г) AlCl3
Задание № 2.
II вариант
В каком соединении
степени окисления
элементов равны +3 и -2
А) NF3
Б) Cl2O3
В) NH3
Г) AlCl3
Слайд 16Тестовое задание
Задание № 3.
I вариант
Схема Na0 → Na+1
отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
Задание № 3.
II
вариантСхема Сl0 → Сl-1
отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
Слайд 17Тестовое задание
Задание № 4.
I вариант
Восстановительные свойства
простых веществ,
образованных элементами
второго периода, с
увеличением заряда ядра:
А) Уменьшаются
Б) Усиливаются
В)
Изменяются периодическиГ) Не изменяются
Задание № 4.
II вариант
Окислительные свойства
простых веществ,
образованных элементами
седьмой группы главной
подгруппы с увеличением
заряда ядра:
А) Уменьшаются
Б) Усиливаются
В) Изменяются периодически
Г) Не изменяются