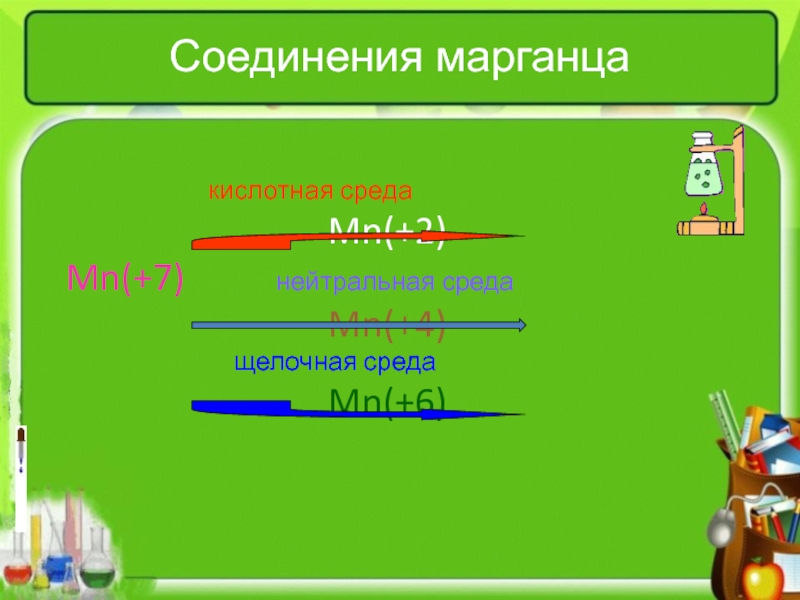
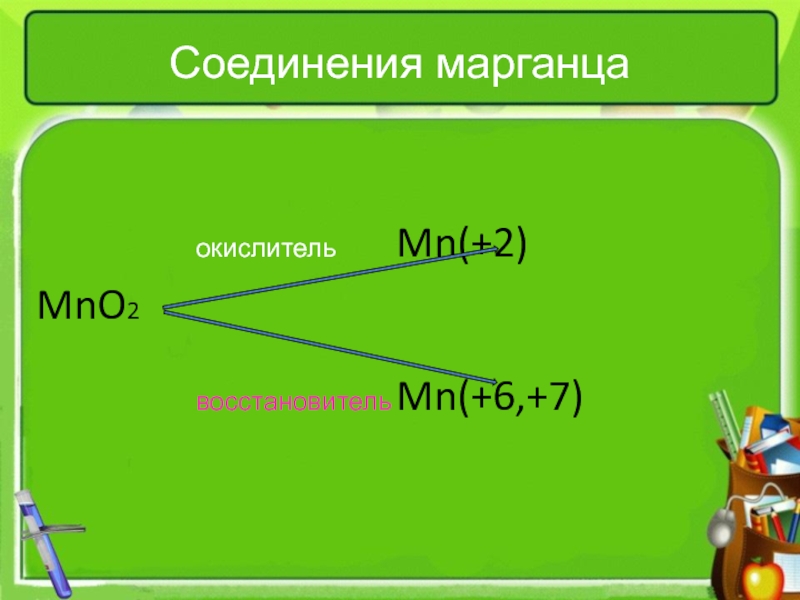
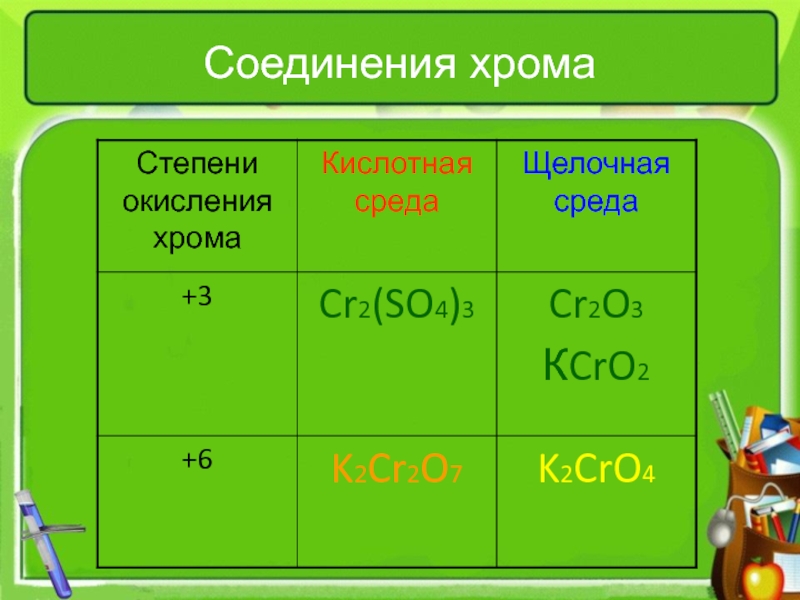
тепловому эффекту
По агрегатному состоянию реагирующих и образующихся веществ
По направлению
По наличию
катализатораПо изменению степени окисления элементов
По механизму протекания
По виду энергии, инициирующей реакцию