Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные законы науки химии
Содержание
- 1. Основные законы науки химии
- 2. Химия – наука о веществах, их строении,
- 3. Атомно – молекулярное учение.Михаил Васильевич Ломоносов(1711
- 4. Основные положения атомно – молекулярного учения.Вещества состоят
- 5. 3. Вещества, молекулы которых состоят
- 6. Периодический закон – фундаментальный закон химии.
- 7. Соответствие показателя строения атома с устройством электронных
- 8. Закон постоянства состава веществ.Жозеф Луи Пруст(1754 –
- 9. Закон сохранения массы вещества.Антуан Лоран Лавуазье
- 10. « Все перемены в
- 11. Закон Авогадро.Амедео Авогадро (1776 – 1856)В равных
- 12. Закон эквивалентов.Иеремия Вениамин Рихтер(1762 – 1807)«Если одно
- 13. где Э –
- 14. Закон кратных отношений.Джон Дальтон(1766 - 1844)
- 15. Уравнение Менделеева – Клапейрона.Формула, устанавливающая зависимость между давлением, молярным объемом и абсолютной температурой идеального газа:
- 16. Закон Бойля – Мариотта.Роберт Бойль(1627 - 1691)
- 17. Для газа данной массы при постоянной температуре произведение давления газа на его объём постоянно:
- 18. Для газа данной массы отношение объёма к
- 19. Задачи для закрепления. Задание № 1. Вычислите
- 20. http://abouthist.net/wp-content/uploads/2011/09/ris15.pnghttps://encryptedtbn2.gstatic.com/images?q=tbn:ANd9GcQIADrHB7WPhmwtO4xJPC3IcoSq5EUlnTioB7bYfL_Wxg_73M3http://class-fizika.narod.ru/phys/15.jpghttp://lichnosti.net/photos/2682/main.jpghttp://img15.nnm.me/3/5/9/c/9/33e15b432c7b16d85194a2064d3.jpghttps://encryptedtbn3.gstatic.com/images?q=tbn:ANd9GcSvAL6XFRPQl_il8l6HJixPr5ZvrCatdd4Ulnl7PCj1nlOy3QPhttp://school-box.ru/images/stories/prezentaziya-po-chimii-zakon-sochraneniya-massi-veshestva.jpghttp://www.calend.ru/img/content_events/i0/349.jpghttp://images.myshared.ru/199103/slide_9.jpghttp://konspekta.net/studopediaorg/baza6/2104455695415.files/image005.pnghttp://image.slidesharecdn.com/reaviz-1-140903150256-phpapp02/95/reaviz-1-19-638.jpg?cb=1409778579http://www.samara.edu.ru/upload/iblock/4ba/Mendeleev.jpghttp://posobie-opt.ru/files/school/175/6.jpghttp://bigslide.ru/images/2/1607/960/img8.jpghttps://encryptedtbn2.gstatic.com/images?q=tbn:ANd9GcRxVjjP02bKEwpLOCwDS9Z6jnm90MsNRFgRWuN8bvf3TRyEABSR8g
- 21. Информация для педагога. Образовательный
- 22. Скачать презентанцию
Слайды и текст этой презентации
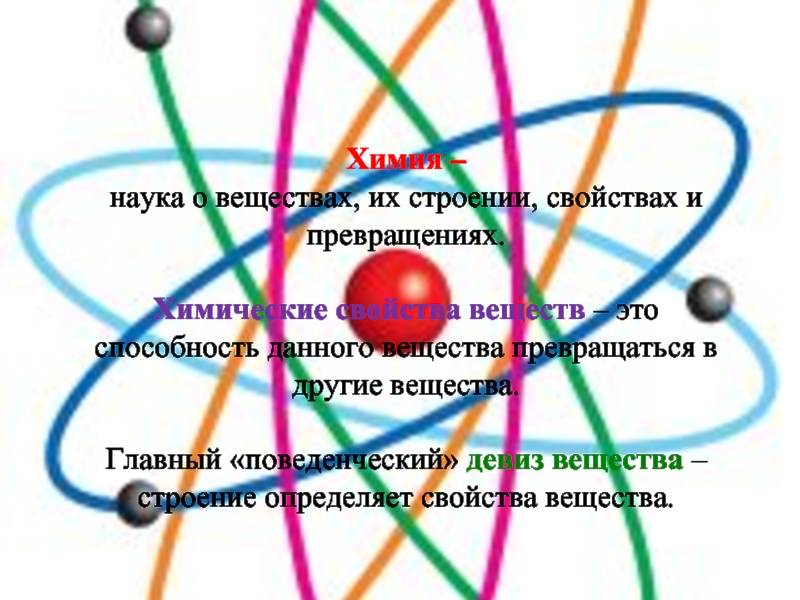
Слайд 2Химия –
наука о веществах, их строении, свойствах и превращениях.
Химические
свойства веществ – это способность данного вещества превращаться в другие
вещества.Главный «поведенческий» девиз вещества – строение определяет свойства вещества.
Слайд 3 Атомно – молекулярное учение.
Михаил Васильевич
Ломоносов
(1711 – 1765)
Джон Дальтон
(1766
– 1844)
Учение создали русский ученый М.В.Ломоносов и английский ученый Дж.Дальтон
в 1741 году.Слайд 4Основные положения атомно – молекулярного учения.
Вещества состоят из молекул. Молекула
-
это наименьшая частица вещества, которая
сохраняет его химические свойства.Молекулы состоят из атомов. Атом – это
наименьшая частица химического элемента,
которая сохраняет его химические свойства.
Химический элемент – это отдельный вид
атомов.
Слайд 5
3. Вещества, молекулы которых состоят из атомов
одного элемента простые вещества. Вещества,
молекулы которых состоят из атомов разных
элементов – сложные вещества.
4. Молекулы и атомы находятся в непрерывном
движении.
5. В результате химических реакций
молекулы одних веществ превращаются в
молекулы других веществ.
Слайд 6Периодический закон – фундаментальный закон химии.
В 1869 году Д. И. Менделеевым был
сформулирован Периодический закон.
Свойства химических элементов , а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядер их атомов.
Дмитрий Иванович Менделеев
( 1834 1907)
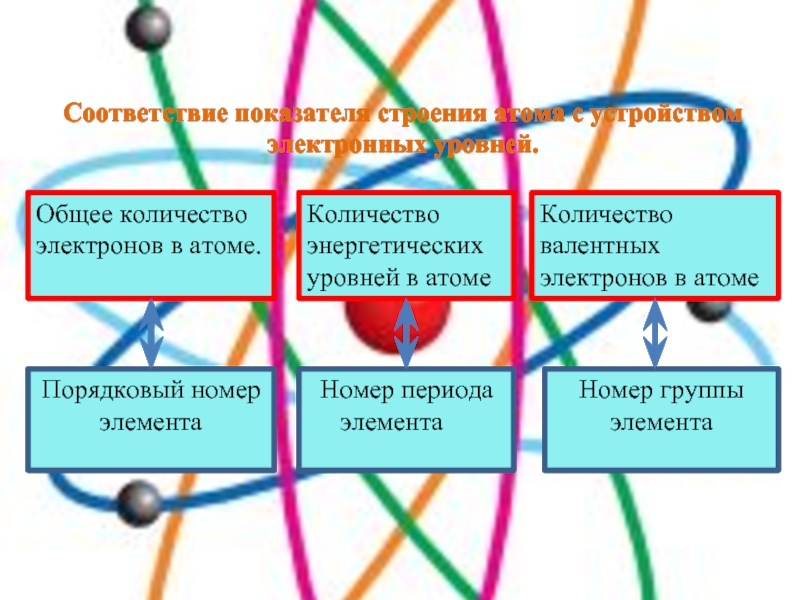
Слайд 7Соответствие показателя строения атома с устройством электронных уровней.
Общее количество электронов
в атоме.
Порядковый номер элемента
Количество энергетических уровней в атоме
Номер периода
элемента
Количество валентных электронов в атоме
Номер группы элемента
Слайд 8Закон постоянства состава веществ.
Жозеф Луи Пруст
(1754 – 1826)
Закон был открыт
французским ученым в 1808 году для вещества молекулярного строения.
Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества.Первая формулировка закона:
От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства.
Слайд 9Закон сохранения массы вещества.
Антуан Лоран Лавуазье
(1743 – 1794)
Михаил
Васильевич Ломоносов
(1711 -1765)
Закон открыт в
1756 г. М. В. Ломоносовым.
В 1789 г.
Подтвержден французским химиком
А. Лавуазье.
Слайд 10 « Все перемены в натуре случающиеся такого
суть состояния, что сколько чего у одного тела отнимается, столько
присовокупится к другому: так ежели где убудет несколько материи, то умножится в другом месте…»М. В. Ломоносов
Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате её.
Слайд 11Закон Авогадро.
Амедео Авогадро
(1776 – 1856)
В равных объемах различных газов
при одинаковых условиях (температура, давление) содержится одинаковое число молекул.
1 моль
газа при T° = 273 К, p = 101325 Па занимает объём V = 22,4 литра.
В одном моле различных веществ содержится
NA = 6,022 х 10²³ молекул ( число Авогадро)
Слайд 12Закон эквивалентов.
Иеремия Вениамин Рихтер
(1762 – 1807)
«Если одно и то же
количество какой-либо кислоты нейтрализуется различными количествами двух или большего числа
оснований, то количества последних эквивалентны и нейтрализуются одним и тем же количеством другой кислоты»И.В.Рихтер (1792)
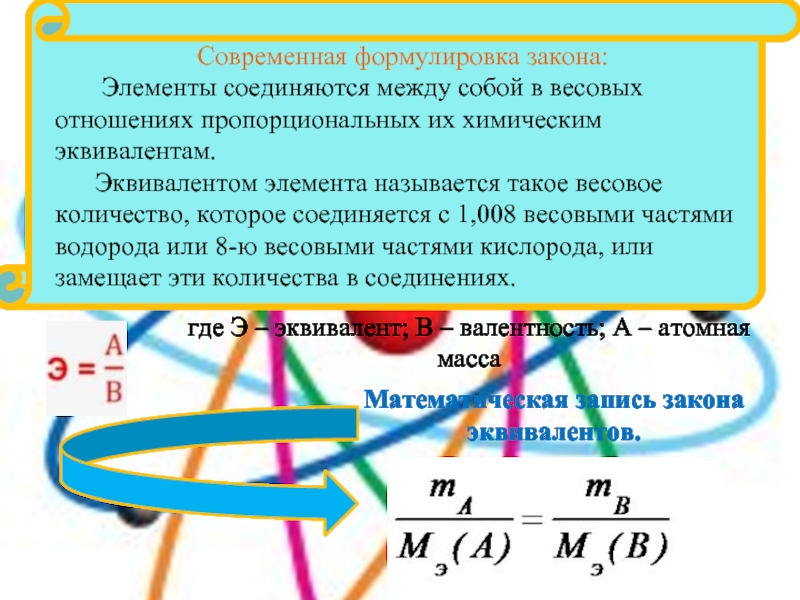
Слайд 13
где Э – эквивалент; В –
валентность; А – атомная масса
Математическая запись закона эквивалентов.
Современная формулировка
закона:Элементы соединяются между собой в весовых отношениях пропорциональных их химическим эквивалентам.
Эквивалентом элемента называется такое весовое количество, которое соединяется с 1,008 весовыми частями водорода или 8-ю весовыми частями кислорода, или замещает эти количества в соединениях.
Слайд 14Закон кратных отношений.
Джон Дальтон
(1766 - 1844)
Закон установлен
в 1803 году
Джоном Дальтоном.Если два простых вещества образуют между собой несколько соединений, то массы одного из них, взаимодействующие с одной и той же массой другого, относятся между собой как небольшие числа.
Слайд 15Уравнение Менделеева – Клапейрона.
Формула, устанавливающая зависимость между давлением, молярным объемом
и абсолютной температурой идеального газа:
Слайд 16Закон Бойля – Мариотта.
Роберт Бойль
(1627 - 1691)
В 1660 году
открыл закон изменения объёма газов с изменением давления, который позднее
получил название закона Бойля – Мариотта: независимо от Бойля этот закон сформулировал французский физик Эдм Мариотт.Эдм Мариотт
Слайд 17 Для газа данной массы при постоянной температуре произведение
давления газа на его объём постоянно:
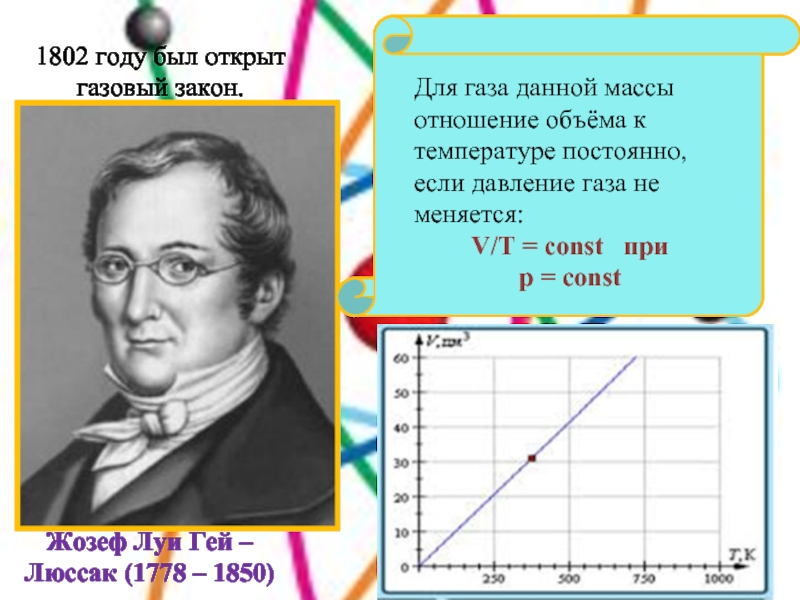
Слайд 18Для газа данной массы отношение объёма к температуре постоянно, если
давление газа не меняется:
V/T = const при
p
= const
Жозеф Луи Гей – Люссак (1778 – 1850)
1802 году был открыт газовый закон.
Слайд 19Задачи для закрепления.
Задание № 1. Вычислите число атомов
азота в 100г карбоната аммония, содержащего 10% неазотистых примесей.
(Ответ: 1,13х1024
атомов азота).Задание № 2. Установите формулу кристаллогидрата сульфата железа (II), если известно, что эта соль содержит 45,32% воды по массе.
(Ответ: FeSO4 х7H2O).
Задание № 3.При каком молярном соотношении оксида серы (VI) и аргона получается смесь, которая в два раза тяжелее воздуха?
(Ответ: ʋ(SO2):ʋ(Ar) =3:1).
Слайд 20http://abouthist.net/wp-content/uploads/2011/09/ris15.png
https://encryptedtbn2.gstatic.com/images?q=tbn:ANd9GcQIADrHB7WPhmwtO4xJPC3IcoSq5EUlnTioB7bYfL_Wxg_73M3
http://class-fizika.narod.ru/phys/15.jpg
http://lichnosti.net/photos/2682/main.jpg
http://img15.nnm.me/3/5/9/c/9/33e15b432c7b16d85194a2064d3.jpg
https://encryptedtbn3.gstatic.com/images?q=tbn:ANd9GcSvAL6XFRPQl_il8l6HJixPr5ZvrCatdd4Ulnl7PCj1nlOy3QP
http://school-box.ru/images/stories/prezentaziya-po-chimii-zakon-sochraneniya-massi-veshestva.jpg
http://www.calend.ru/img/content_events/i0/349.jpg
http://images.myshared.ru/199103/slide_9.jpg
http://konspekta.net/studopediaorg/baza6/2104455695415.files/image005.png
http://image.slidesharecdn.com/reaviz-1-140903150256-phpapp02/95/reaviz-1-19-638.jpg?cb=1409778579
http://www.samara.edu.ru/upload/iblock/4ba/Mendeleev.jpg
http://posobie-opt.ru/files/school/175/6.jpg
http://bigslide.ru/images/2/1607/960/img8.jpg
https://encryptedtbn2.gstatic.com/images?q=tbn:ANd9GcRxVjjP02bKEwpLOCwDS9Z6jnm90MsNRFgRWuN8bvf3TRyEABSR8g
Слайд 21Информация для педагога.
Образовательный ресурс найдет широкое
применение при изучении школьного курса химии. Возможен вариант использования в
8 классе при изучении соответствующих химических законом.В 11 классе при изучении общей химии «Методы и законы химической науки». Можно использовать ресурс в полном объёме.
Есть возможность использовать при подготовке к итоговой аттестации по предмету химия.
Целесообразно использование ресурса при дистанционном обучении.