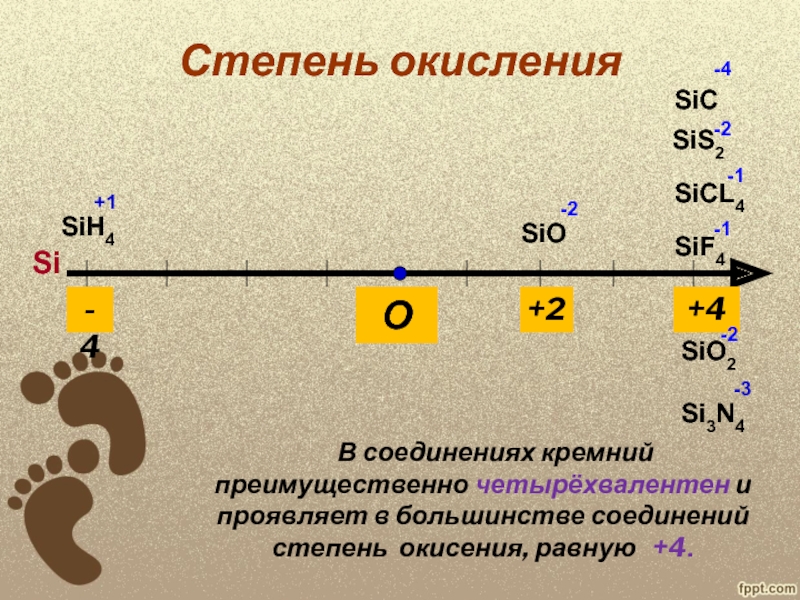
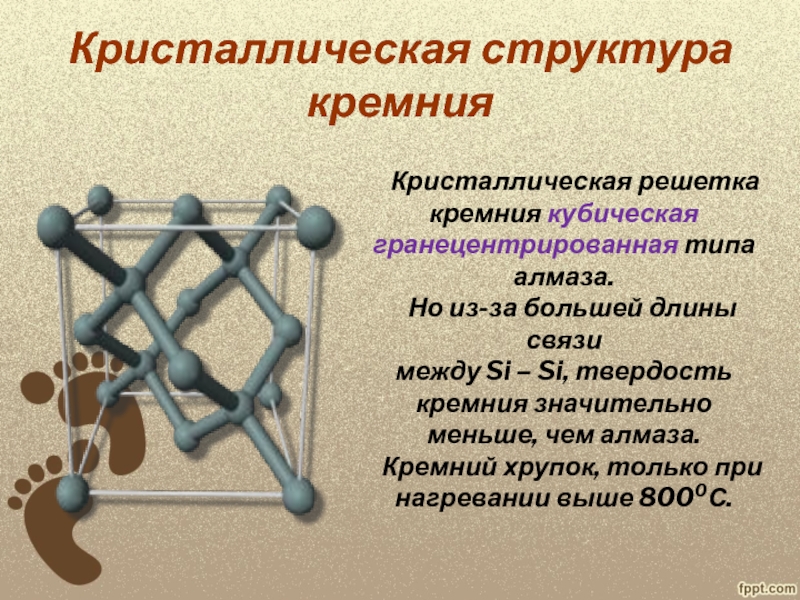
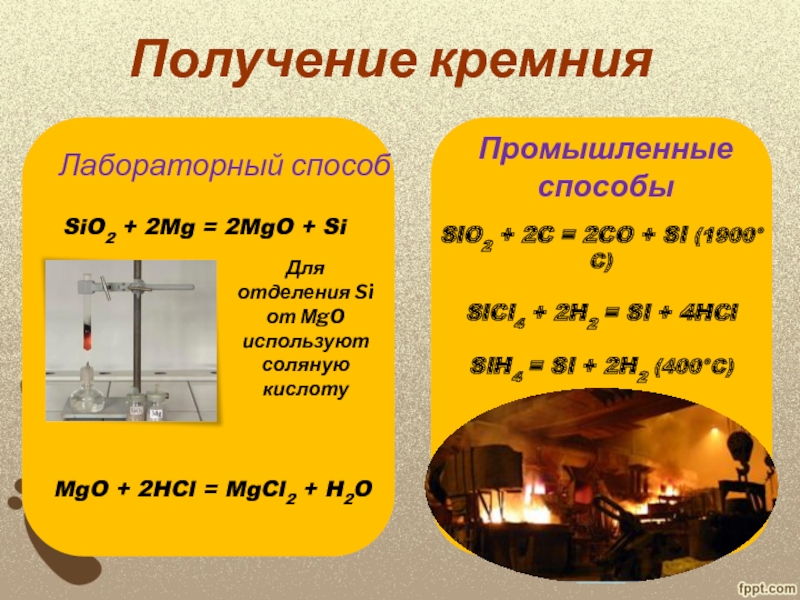
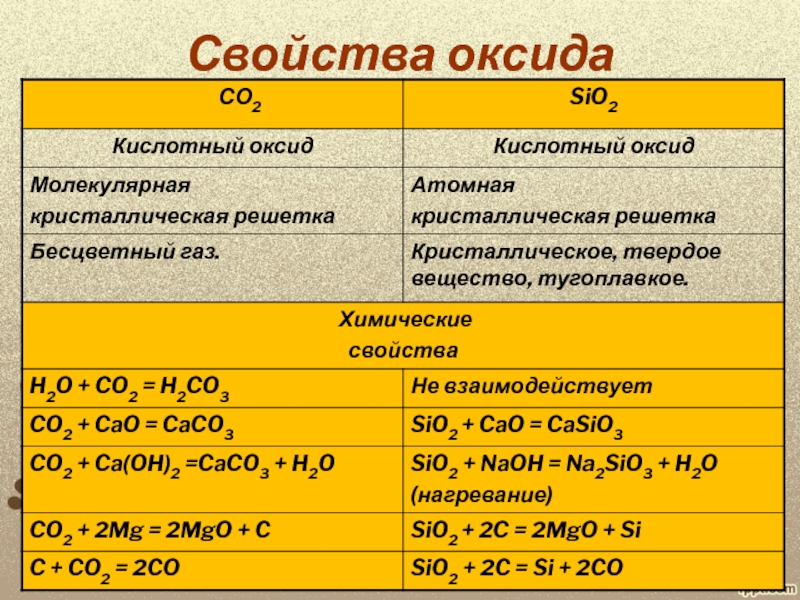
в 1825 году действием металлического калия на фтористый кремний SiF4
Русское
название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе с древнегреческого κρημνός — «утес, гора».История открытия