Слайд 2Структура части С КИМов по химии в 2006 году
С1. Окислительно-восстановительные
реакции
С2. Составление возможных уравнений реакций
С3. Цепочки превращений в органической химии
С4.
Расчётные задачи по темам: «Растворы», «Расчёты по уравнению реакции»
С5. Задача на вывод формулы вещества
Слайд 3Окислительно-восстановительные реакции
Основное правило, которое используется при определении продуктов ОВР: один
элемент понижает свою степень окисления, другой элемент повышает свою степень
окисления. Продукты реакции зависят от среды. В кислой среде изменение степени окисления происходит более глубоко.
Слайд 4Окислительно-восстановительные реакции
С1. Используя метод электронного баланса, составьте уравнение реакции:
P +
HClO3 + ...= HCl + …
Определите окислитель и восстановитель.
РЕШЕНИЕ:
Определим степени
окисления и установим, какой элемент будет понижать степень окисления, а какой – повышать.
P0 + H Cl+5O3+ …= HCl-1 + …
В данном уравнении Сl+5 (окислитель) превращается в Сl-1 , следовательно, P0 (восстановитель) будет повышать свою степень окисления до P+5
Переход электронов:
P0-5e- = P+5 6
Cl+5+6e- = Cl-1 5
Уравнение имеет вид:
6P + 5HClO3 + 9H2O = 5HCl + 6H3PO4
Слайд 5Окислительно-восстановительные реакции
С1. Используя метод электронного баланса, составьте уравнение:
Al + K2Cr2O7
+ … = … + Cr2(SO4)3 + K2SO4 + H2O
РЕШЕНИЕ:
Al0
+ K2Cr2+6O7 + … = … + Cr2+3(SO4)3 + K2SO4 + H2O
Al0 повышает степень окисления до +3, Cr+6 понижает степень окисления до Cr+3. В качестве среды выступает серная кислота.
Переход электронов:
Al0 - 3e- = Al+3 2 восстановитель
2Cr+6 + 6e- = 2Cr+3 1 окислитель
Уравнение имеет вид:
2Al + K2Cr2O7 + 7H2SO4 = Al2(SO4)3 + Cr2(SO4)3+ K2SO4+ 7H2O
Слайд 6Окислительно-восстановительные реакции
Примеры окислительно-восстановительных реак-ций в заданиях С1:
a) SO2 + K2Cr2O7
+ … = K2SO4 + … + H2O
б) KNO2 +
K2Cr2O7 + …= KNO3 + Cr(NO3)3 + H2O
в) KIO3 + … + H2SO4 = I2 + K2SO4 + H2O
Слайд 7Составление возможных уравнений реакций
С2. Даны водные растворы: сульфида натрия, сероводорода,
хлорида алюминия и хлора. Напишите уравнения четырёх возможных реакций между
этими веществами.
РЕШЕНИЕ:
Na2S + H2S = 2NaHS
H2S + 4Cl2 + 4H2O = 8HCl + H2SO4
Na2S + Cl2 = 2NaCl + S
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 6NaCl + 3H2S
Слайд 8Составление возможных уравнений реакций
С2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6],
хлорида алюминия, сероводорода и гидроксида рубидия. Напишите уравнения четырёх возможных
реакций между этими веществами.
РЕШЕНИЕ:
K3[Al(OH)6] + 3H2S = 3K2S + 2Al(OH)3 + 6H2O
H2S + 2RbOH = Rb2S + 2H2O или
Н2S + RbOH = RbHS + H2O
AlCl3 + 3RbOH = 3RbCl + Al(OH)3 или
AlCl3 + 4RbOH = 3RbCl + Rb[Al(OH)4]
2AlCl3+ 3H2S = Al2S3 + 6HCl
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Слайд 9Составление возможных уравнений реакций
С2. Даны водные растворы: гексагидроксохромата натрия Na3[Cr(OH)6],
хлорида железа (III), сернистого газа и перекиси водорода. Напишите уравнения
четырёх возможных реакций между этими веществами.
РЕШЕНИЕ:
SO2 + H2O2 = H2SO4
2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl
2Na3[Cr(OH)6] +3H2O2 = 2Na2CrO4 + 2NaOH + 8H2O
Na3[Cr(OH)6] + FeCl3 = Fe(OH)3 + Cr(OH)3 + 3NaCl
Слайд 10Составление возможных уравнений реакций
C2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6],
хлорида хрома (III), карбоната калия и угольной кислоты. Напишите уравнения
четырёх возможных реакций между этими веществами.
РЕШЕНИЕ:
K2CO3 + H2CO3 = 2KHCO3
2CrCl3 + 3K2CO3 + 3H2O = 2Cr(OH)3 + 3CO2 + 6KCl
K3[Al(OH)6] + CrCl3 = Cr(OH)3 + Al(OH)3 + 3KCl
2K3[Al(OH)6] + 3H2CO3 = 3K2CO3 + 2Al(OH)3 + 6H2O
Слайд 11Взаимосвязь органических веществ
C3. Напишите уравнения реакций, с помощью которых можно
осуществить превращения:
H2SO4(конц.),t Br2 H2O, Hg2+ H2, кат.
Пропанол-1 Х1 Х2 пропин Х3 Х4
РЕШЕНИЕ:
CH3–CH2–CH2–OH → CH3–CH=CH2 + H2O
CH3–CH=CH2 + Br2 → CH3–CHBr–CH2Br
CH3–CHBr–CH2Br + 2KOH → 2KBr + 2H2O + CH3–C≡CH
CH3–C≡CH + HOH → CH3–CO–CH3
CH3–CO–CH3 + H2 → CH3–CHOH–CH3
Слайд 12Взаимосвязь органических веществ
C3. Напишите уравнения реакций, с помощью которых можно
осуществить превращения:
KOH(спирт.), t t, Cакт CH3Cl, AlCl3 KMnO4, H2SO4
С2Н4 С2H4Cl2 Х1 C6H6 Х2 C6H5COOH
РЕШЕНИЕ:
C2H4 + Cl2 → C2H4Cl2
C2H4Cl2 + 2KOH → 2KCl + 2H2O + C2H2
3C2H2 → C6H6
C6H6 + CH3Cl → C6H5CH3 + HCl
5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O
Слайд 13Взаимосвязь органических веществ
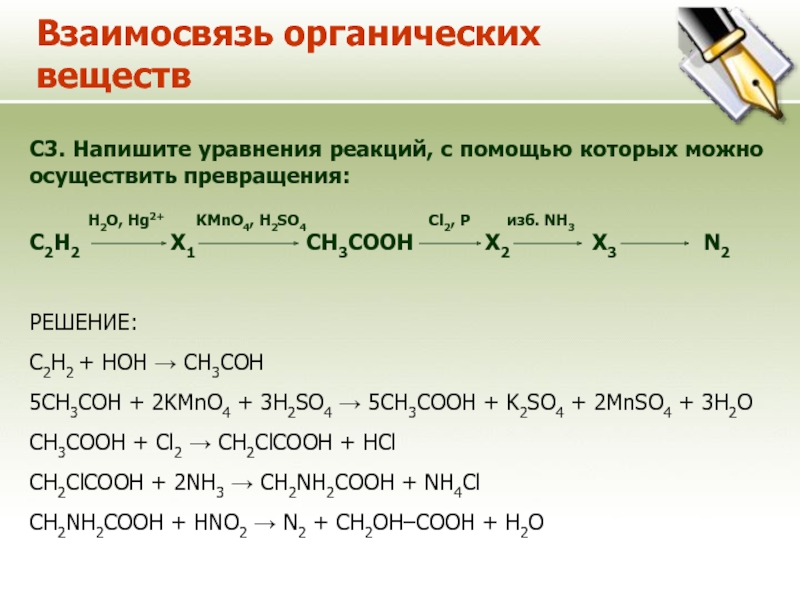
C3. Напишите уравнения реакций, с помощью которых можно
осуществить превращения:
H2O, Hg2+
KMnO4, H2SO4 Cl2, P изб. NH3
C2H2 Х1 CH3COOH Х2 Х3 N2
РЕШЕНИЕ:
С2H2 + HOH → CH3COH
5CH3COH + 2KMnO4 + 3H2SO4 → 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O
CH3COOH + Cl2 → CH2ClCOOH + HCl
CH2ClCOOH + 2NH3 → CH2NH2COOH + NH4Cl
CH2NH2COOH + HNO2 → N2 + CH2OH–COOH + H2O
Слайд 14Взаимосвязь органических веществ
C3. Примеры заданий:
2HCl, t
изб. NaOHспирт., t t, Cакт. Cl2, AlCl3 изб. NaOH, t
Этиленгликоль Х1 Х2 С6Н6 Х3 Х4
Na t, kat, (-4H2) AlCl3, CH3Cl KMnO4, H2SO4 NaOH
1-бромпропан Х1 Х2 Х3 С6Н5СООН Х4
Слайд 15Расчёты по уравнениям реакций
С4. Для окисления некоторого количества серы потребовался
такой объем кислорода (н.у.), который образуется при разложении 215 г
хлората калия, содержащего 5% бескислородной примеси. Определите массу серы, вступившей в реакцию, и объем образовавшегося газообразного продукта окисления.
РЕШЕНИЕ:
2KClO3 = 2KCl + 3O2
m(KClO3) =215 ∙ 0,95 = 204,24 г; n(KClO3) = 1,667 моль
По уравнению реакции рассчитаем количество вещества кислорода.
n(O2) = 2,5 моль
S + O2 = SO2
По уравнению реакции n(S) = n(SO2) = n(O2) = 2,5 моль
m(S) = 2,5 моль ∙ 32 г/моль = 8 г
V(SO2) = 2,5 моль ∙ 22,4 л/моль = 56 л
ОТВЕТ: 56 л SO2; 8 г S.
Слайд 16Расчёты по уравнениям реакций
C4. Примеры заданий:
а) Для окисления некоторого количества
аммиака потребовался такой объём кислорода (н.у.), который образуется при разложении
245,6 г перманганата калия, содержащего 3,5% бескислородной примеси. Определите массу аммиака, вступившего в реакцию, и объём образовавшегося азотсодержащего продукта окисления (н.у.).
б) Для окисления некоторого количества серы потребовался такой объём кислорода (н.у.), который образуется при разложении 330,9 г перманганата калия, содержащего 4,5 % бескислородной примеси. Определите массу серы, вступившей в реакцию, и объём образовавшегося продукта окисления.
Слайд 17Расчёты по теме «Растворы»
С4. Смешали 100 мл 15% раствора гидроксида
калия (плотностью 1,10 г/мл) и 150 мл 10% раствора соляной
кислоты (плотностью 1,05 г/мл). Определите среду полученного раствора и массовую долю хлорида калия в нем.
РЕШЕНИЕ:
KOH + HCl = KCl + H2O
Найдем массу каждого раствора и массу вещества.
mр-ра(KOH) =100 ∙ 1,1 = 110 г ; m(KOH) = 110 ∙ 0,15= 16,5 г
mр-ра(HCl) = 150 ∙ 1,05 = 157,5 г ; m( HCl) = 157,5 ∙ 0,1 = 15,75 г
Найдем количество вещества для каждого соединения.
n(KOH) = 0,294 моль; n(HCl) = 0,43 моль; n(KCl) = 0,294 моль
Среда кислая
Найдем массу соли m(KCl) = 21,9 г
Рассчитаем массу общего раствора: m(р-ра) = 110 + 157,5 = 267,5 г
Определим массовую долю хлорида калия в растворе: ω= 21,9/267,5 = 0,08
Слайд 18Расчёты по теме «Растворы»
С4. Примеры заданий:
К раствору, полученному при добавлении
8 г гидрида лития к 1 л воды, прилили 100
мл 8,5% раствора соляной кислоты (плотность 1,04 г/мл). Определите массовые доли растворённых веществ в полученном растворе.
Слайд 19Задачи на вывод формулы вещества
С5. При сгорании газообразного органического вещества,
не содержащего кислород, выделилось 2,24 л (н.у.) углекислого газа, 1,8
г воды и 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
Решение:
Установим количества вещества углерода, водорода и хлора.
1) 22,4 л СO2 – 1 моль n (C)= 0, 1 моль
2,24 л СO2 – х моль
2) 36,5 г HCl – 35,5 г Сl z(Cl) = 3,55 г Cl; n(Cl)=0,1 моль
3,65 г HCl – z г Cl
3) 36,5 г НСl – 1 г H у(H)= 0,1 г; n(H) = 0,1 моль
3,65 г HCl – у г H
18 г H2O – 2 г H у1=0,2 г; n1(H)= 0,2 моль
1,8 г Н2O – у1 г H
Общее количество вещества водорода составляет 0,3 моль.
х :у :z = 0,1: 0,3: 0,1. Формула СH3Cl.
Слайд 20Расчёты по теме «Растворы»
C5. Образцы заданий:
а) Установите формулу неорганического соединения,
содержащего 20% магния, 53,33% кислорода и 26,67% некоторого элемента.
б) При
полном сгорании газообразного органического вещества, не содержащего кислород, выделилось 4,48 л (н.у.) углекислого газа, 1,8 г воды и 4 г фтороводорода. Установите формулу сгоревшего соединения.
в) При термическом разложении неизвестного вещества массой 49 г выделилось 13,44 л (н.у.) кислорода и осталось твердое вещество, содержащее 52,35% калия и 47,65% хлора. Определите формулу вещества.







![ЕГЭ ПО ХИМИИ Составление возможных уравнений реакцийС2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6], хлорида Составление возможных уравнений реакцийС2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6], хлорида алюминия, сероводорода и гидроксида рубидия. Напишите](/img/thumbs/d58506ec2760ae3bd013d87ace5c806c-800x.jpg)
![ЕГЭ ПО ХИМИИ Составление возможных уравнений реакцийС2. Даны водные растворы: гексагидроксохромата натрия Na3[Cr(OH)6], хлорида Составление возможных уравнений реакцийС2. Даны водные растворы: гексагидроксохромата натрия Na3[Cr(OH)6], хлорида железа (III), сернистого газа и перекиси](/img/thumbs/aac4497d40426beb9f226aa2be4aaae8-800x.jpg)
![ЕГЭ ПО ХИМИИ Составление возможных уравнений реакцийC2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6], хлорида Составление возможных уравнений реакцийC2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6], хлорида хрома (III), карбоната калия и угольной](/img/thumbs/c720a99cc02e2260f39fef8bd8f8e9ad-800x.jpg)