Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Амины. Аминокислоты.
Содержание
- 1. Амины. Аминокислоты.
- 2. Цель Урока: Учебная: - Расширить
- 3. Подготовка к восприятию нового материала
- 4. Ответьте на тестовые вопросы: Назовите имя химика,
- 5. В) Ф. ВелерПравильный ответ:
- 6. Химическая формула, показывающая порядок соединения атомов в
- 7. Правильный Ответ:Д) Структурная
- 8. Вещества, имеющие одинаковый состав молекул (т.е. одну
- 9. Правильный Ответ :Б) Изомеры
- 10. Создатель теории химического строения органических веществ. А)
- 11. Правильный Ответ :Александр Михайлович Бутлеров
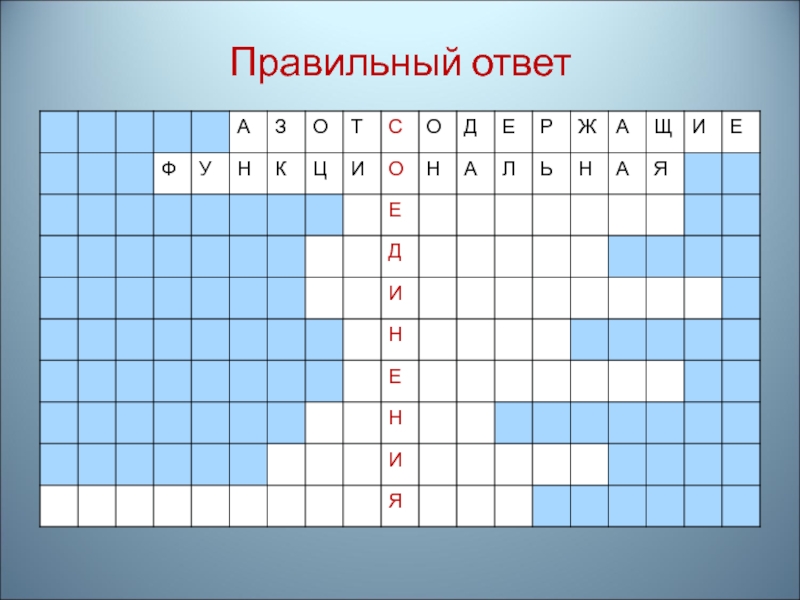
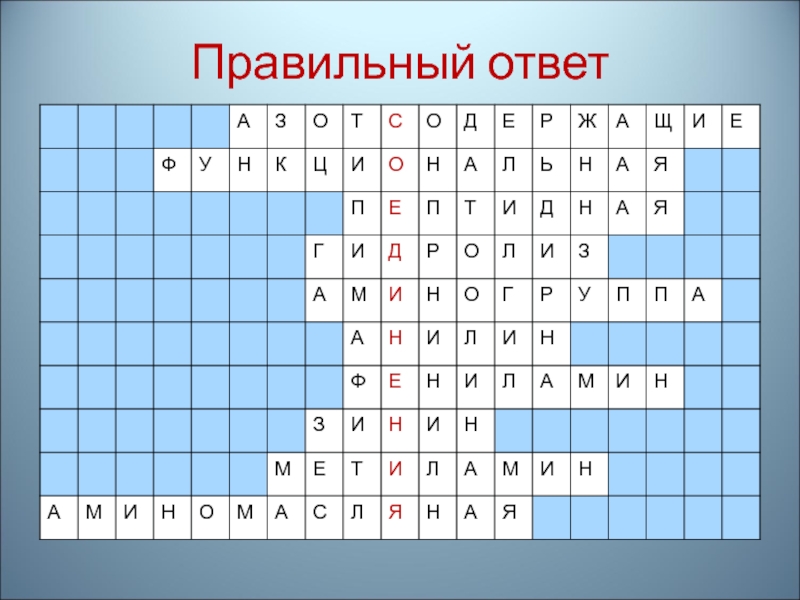
- 12. Разгадайте анаграмму: розсажотдщенае доесияниен
- 13. Правильный ответ: Азотсодержащие соединения
- 14. Закончите определение: Соединения , функциональные группы которых содержат кислород…
- 15. Правильный ответ:Называются кислородсодержащими органическими соединениями
- 16. Функциональными группами определяются…
- 17. Правильный ответ : Свойства отдельных классов органических соединений
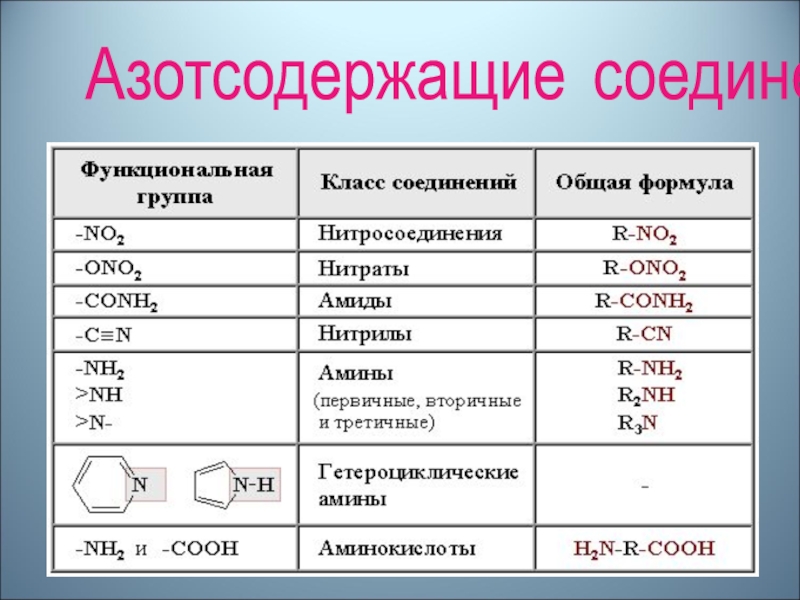
- 18. Соединения, функциональные группы которых содержат азот…
- 19. Правильный ответ : Азотсодержащие органические соединения
- 20. Азотсодержащие соединения
- 21. Изучение нового материала
- 22. План урока1.Дать понятие аминам. Строение и классификация
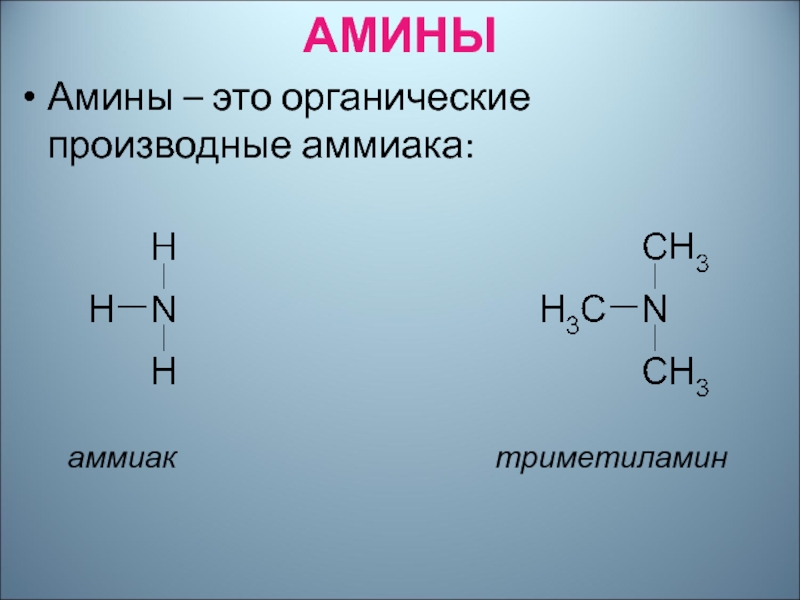
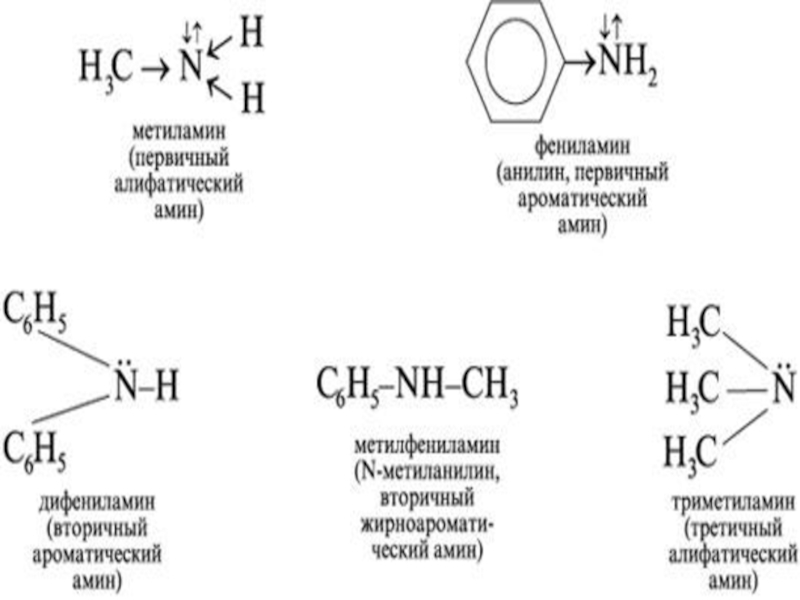
- 23. Амины-производные аммиака , в молекулах которого один или несколько атомов водорода замещены углеводородными радикалами.
- 24. АМИНЫАмины – это органические производные аммиака:аммиак
- 25. Амины классифицируются в зависимости от природы
- 26. По числу замещённых атомов водорода различают Первичные-
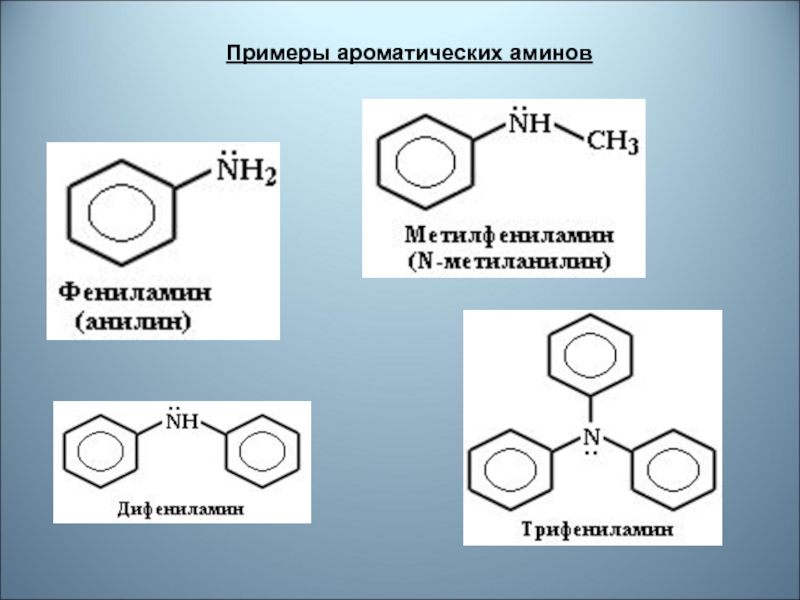
- 27. Примеры ароматических аминов
- 28. Слайд 28
- 29. Номенклатура К названию органических остатков, связанных с
- 30. Изомерия Структурная изомерия - углеродного скелета,
- 31. Изомерия углеродного скелета Изомерия положения аминогруппы
- 32. Получение аминовВ результате этой реакции образуется соль
- 33. При взаимодействии полученного первичного амина и галогенопроизводного и последующей обработке щелочью получают вторичный амин (диэтиламин):
- 34. Повторение процедуры приводит к образованию третичного амина:
- 35. Третичный амин может ещё раз вступить в
- 36. Амины получают восстановлением нитросоединений в присутствии катализатора
- 37. Восстановлением азотсодержащих соединений: нитросоединений (реакция
- 38. Физические свойства аминов При обычной температуре только
- 39. Вредное воздействие Амины являются очень токсичными
- 40. Наличие неподелённой пары электронов у атома азота
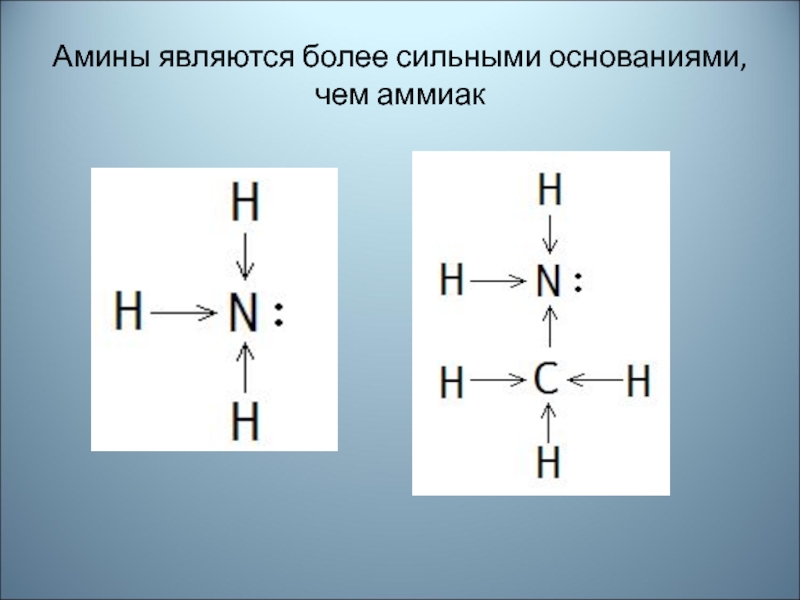
- 41. Амины являются более сильными основаниями, чем аммиак
- 42. Амины как основания
- 43. -Первичные и вторичные амины взаимодействуют с азотистой
- 44. Амины способны окисляться с образованием различных
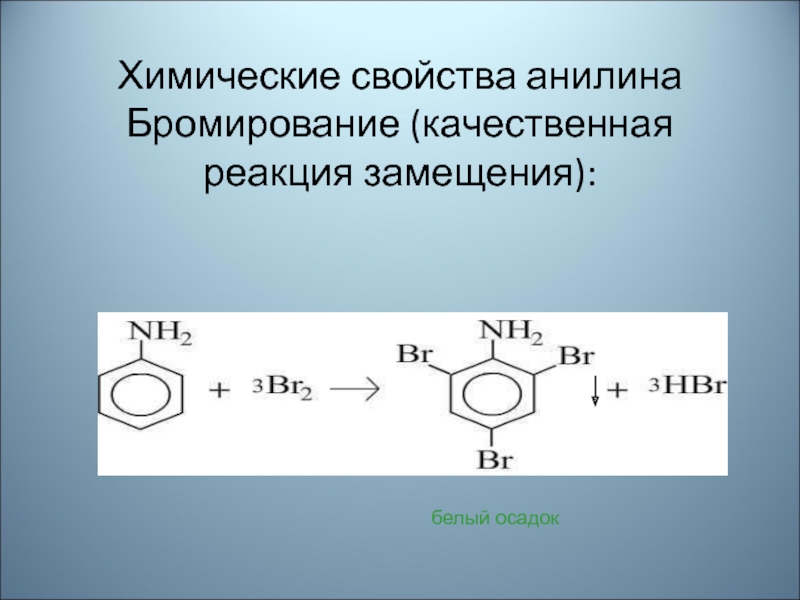
- 45. Химические свойства анилина Бромирование (качественная реакция замещения): белый осадок
- 46. Окисление анилина.При окислении анилина образуются анилиновые
- 47. ПрименениеВ настоящий момент в мире основная часть
- 48. Аминокислоты
- 49. Аминокислоты – гетерофункциональные соединения, которые
- 50. Аминокислоты. Биологическая рольАминокислоты, в отличие от ранее изученных органических веществ, содержат две функциональные группы.
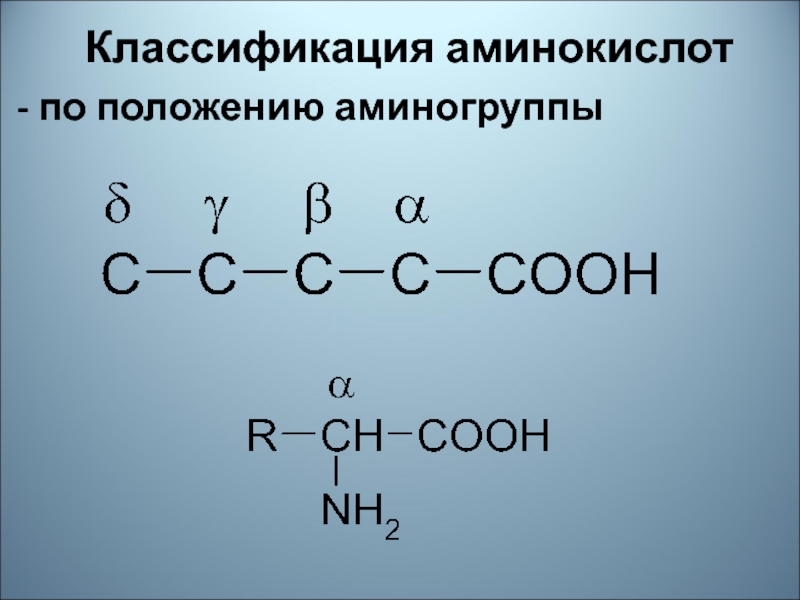
- 51. Классификация аминокислот- по положению аминогруппы
- 52. *Нижник Я.П. http://norgchem.professorjournal.ru- По количеству карбокси- и
- 53. *Нижник Я.П. http://norgchem.professorjournal.ru-Классификация по встречаемости в белках
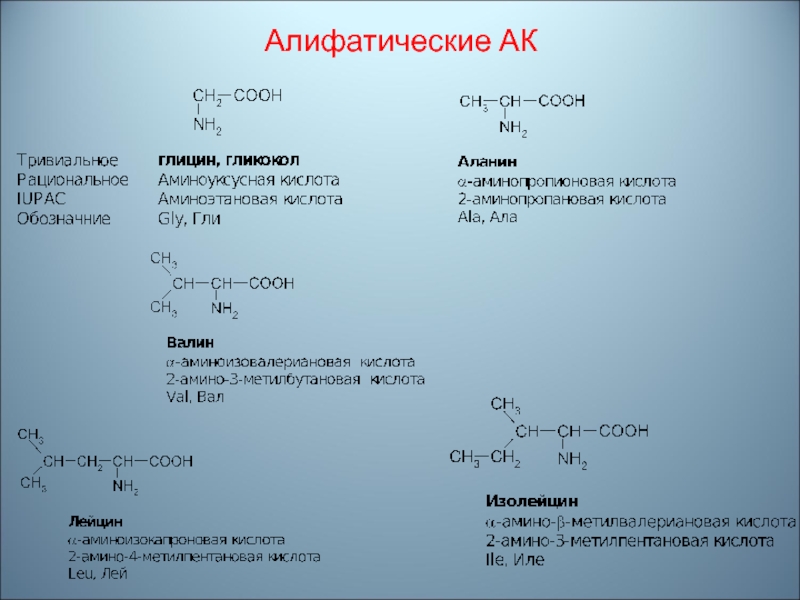
- 54. Алифатические АК
- 55. Содержащие ОН-группу Ceринα-амино-β-оксипропионовая кислота2-амино-3-гидроксипропановая кислотаSer, Сeр Трeонинα-амино-β-оксимасляная кислота2-амино-3-гидроксибутановая кислотаThr, Трe
- 56. Серосодержащие АКЦистеин
- 57. Моноаминодикарбоновые кислоты и их амидыАспарагиновая кислотаАминоянтарная кислотаАминобутандиовая
- 58. Содержащие аминогруппуЛизинα,ε-диаминокапроновая кислота2,6-диаминогексановая кислотаLys, ЛизАргининα-амино-δ-гуанидилвалериановая кислота2-амино-5-[амино(имино)метил]аминопентановая к-таArg, Арг
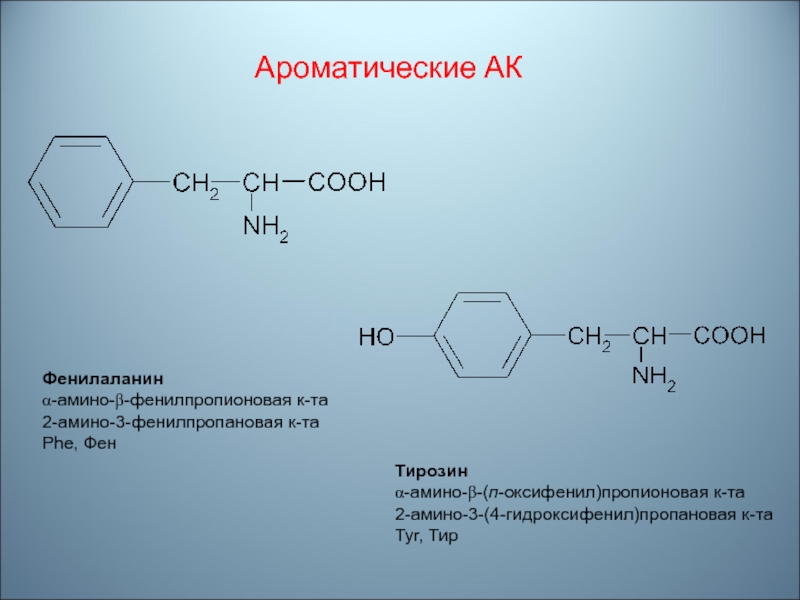
- 59. Ароматические АКФенилаланинα-амино-β-фенилпропионовая к-та2-амино-3-фенилпропановая к-таPhe, ФенТирозинα-амино-β-(п-оксифенил)пропионовая к-та2-амино-3-(4-гидроксифенил)пропановая к-таTyr, Тир
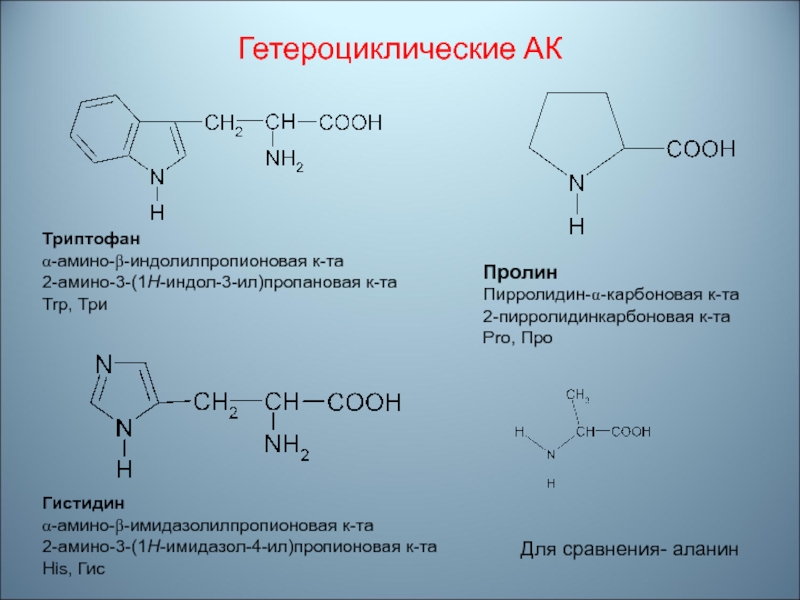
- 60. Гетероциклические АКТриптофанα-амино-β-индолилпропионовая к-та2-амино-3-(1H-индол-3-ил)пропановая к-таTrp, ТриГистидинα-амино-β-имидазолилпропионовая к-та2-амино-3-(1H-имидазол-4-ил)пропионовая к-таHis, ГисПролинПирролидин-α-карбоновая к-та2-пирролидинкарбоновая к-таPro, ПроДля сравнения- аланин
- 61. По
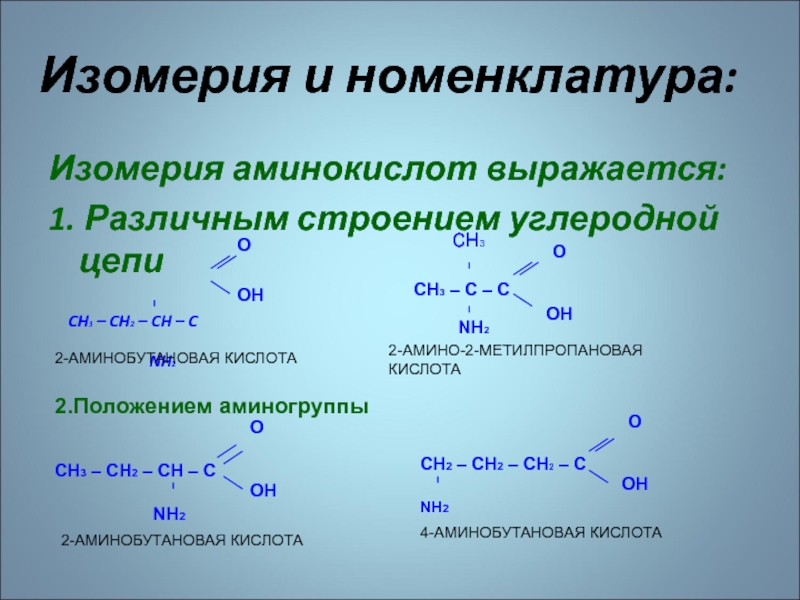
- 62. Изомерия аминокислот выражается:1. Различным строением углеродной цепи
- 63. Слайд 63
- 64. Слайд 64
- 65. лабораторный уксусная кислота →хлоруксусная кислота→аминоуксусная кислотаСН3-СООН +
- 66. Физические свойстваАминокислоты, как правило, являются бесцветными
- 67. Химические свойства:1) Растворимость в воде (атом водорода
- 68. Образование полипептидов
- 69. Применение аминокислот
- 70. В живых организмах:Природные аминокислоты (около 150)Протеиногенные аминокислоты
- 71. Закрепление нового материала
- 72. Решение кроссворда
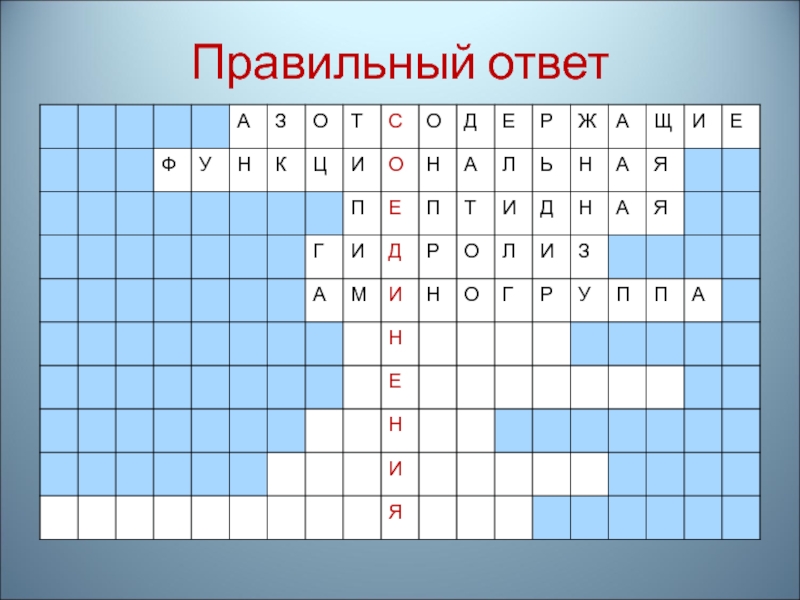
- 73. 1.Соединения,в молекуле которых функциональная группа содержит атом азота
- 74. Правильный ответ
- 75. 2.Группа атомов, определяющая определенные свойства веществ
- 76. Правильный ответ
- 77. 3.Связь, соединяющая остатки аминокислот в молекулах белков
- 78. Правильный ответ
- 79. 4.Способ получения аминокислот, входящих в состав белков
- 80. Правильный ответ
- 81. 5. Название группы атомов – NH2
- 82. Правильный ответ
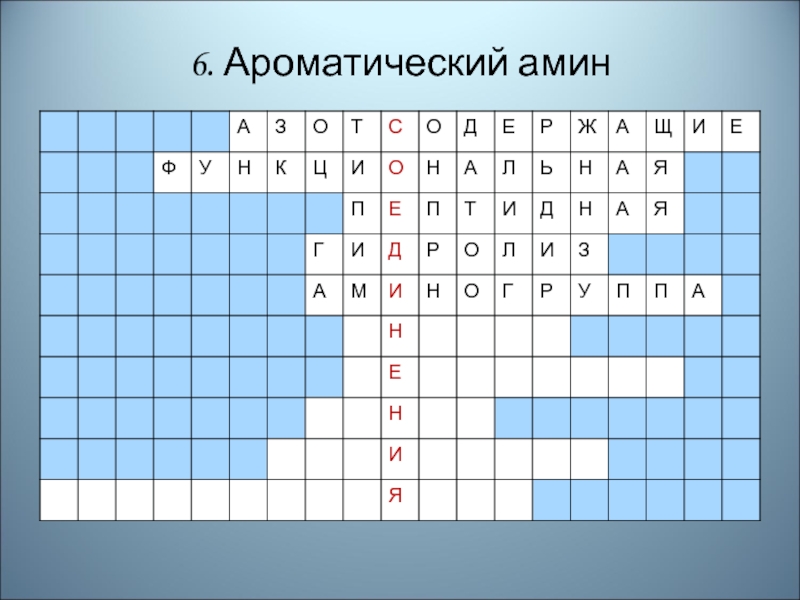
- 83. 6. Ароматический амин
- 84. Правильный ответ
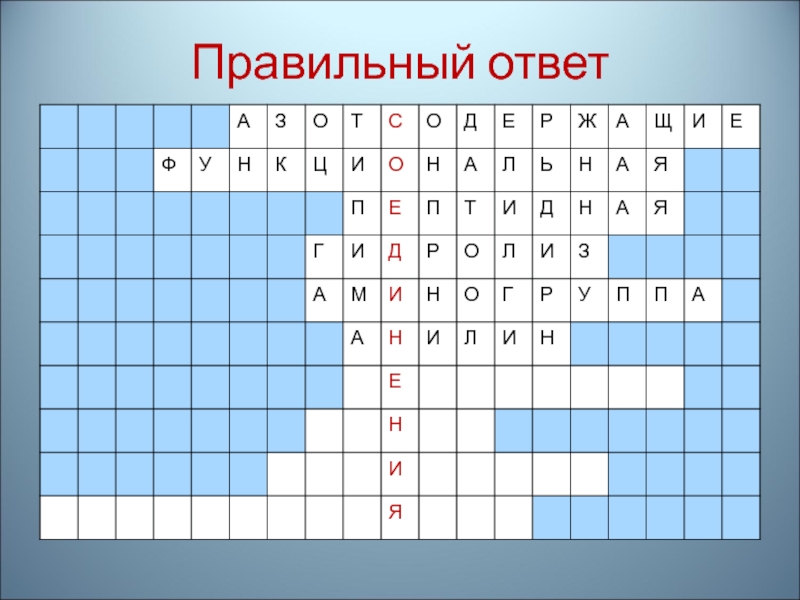
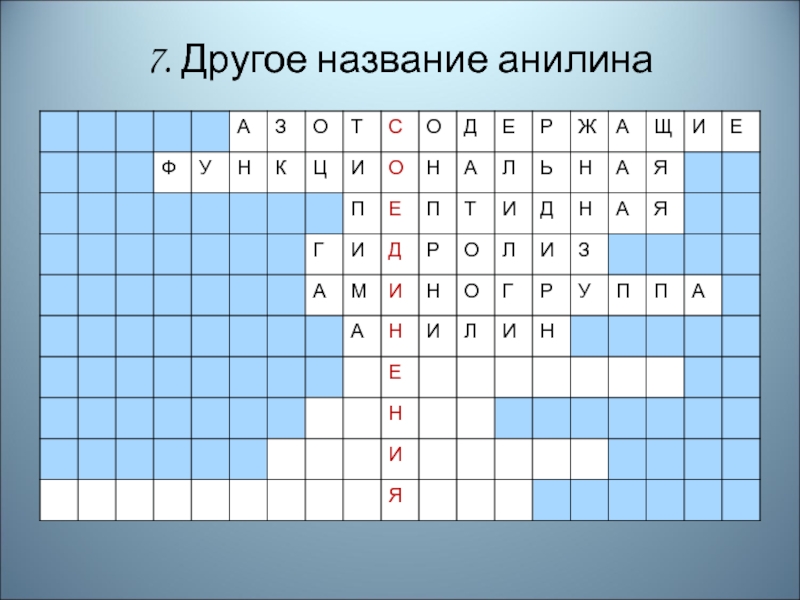
- 85. 7. Другое название анилина
- 86. Правильный ответ
- 87. 8. Русский химик-органик, который открыл реакцию восстановления ароматических нитросоединений и получил анилин
- 88. Правильный ответ
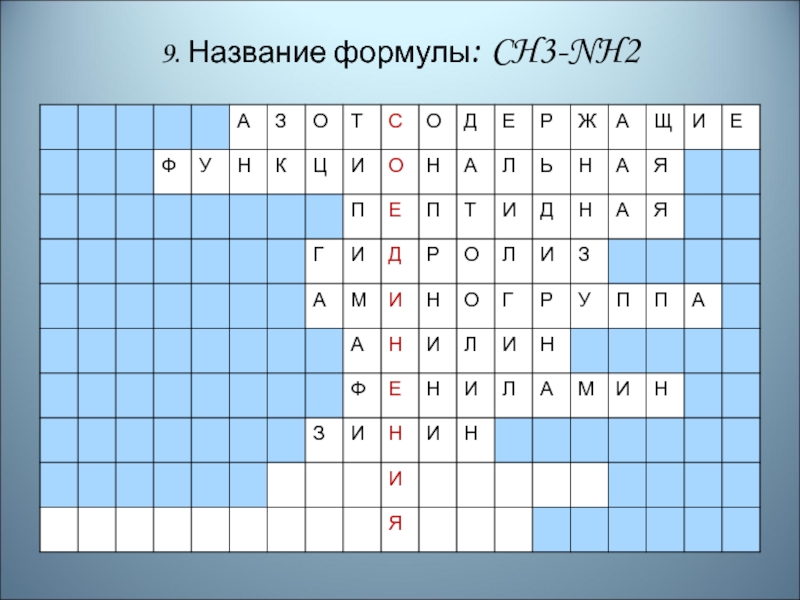
- 89. 9. Название формулы: CH3-NH2
- 90. Правильный ответ
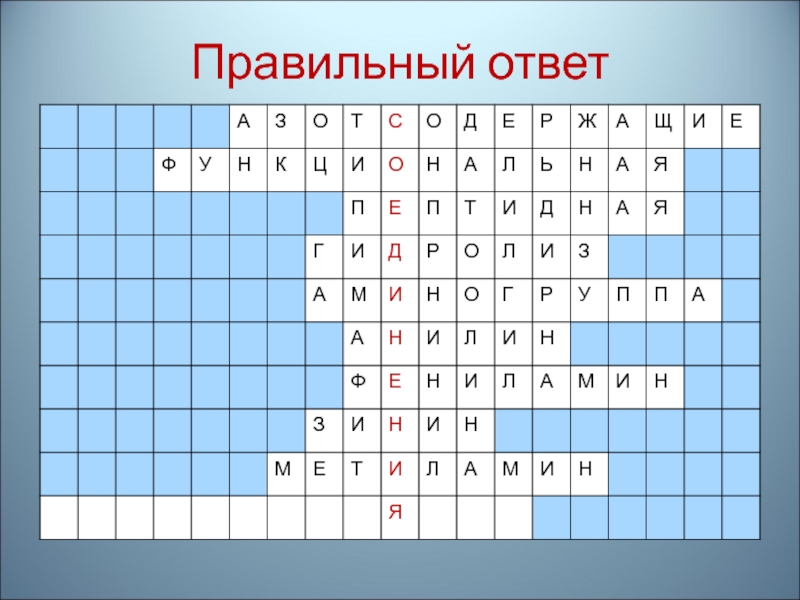
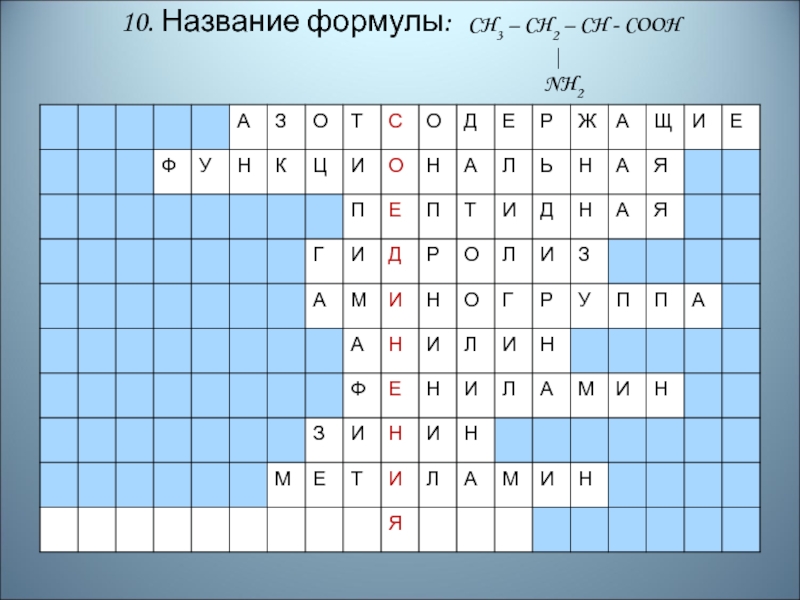
- 91. 10. Название формулы: CH3 – CH2 –
- 92. Правильный ответ
- 93. Словарь химических терминов:Амины – Аминдер- Amines азотсодержащие
- 94. Домашнее заданиеПо учебнику Н. Нурахметов, А. Темирбулатова,
- 95. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Цель Урока: Учебная: - Расширить знания студентов по изучению нового
класса азотсодержащих органических веществ - Систематизировать и углубить знания о кислотах,
дать представление об аминокислотах и аминах - Ознакомить со строением, свойствами, и применением этих веществ. Воспитательная: - Воспитание интереса к предмету. - Умение выступать перед аудиторией , оперативности. Развивающая: - Развитие творческого мышления, внимания , компетентности.Слайд 4Ответьте на тестовые вопросы: Назовите имя химика, который впервые нанес удар
взглядам виталистов: А) А.М. Бутлеров Б) Ф.А. Кекуле В) Ф. Велер Г) В.В. Марковников Е)
Ш.А. ВюрцСлайд 6Химическая формула, показывающая порядок соединения атомов в молекулах: А) Графическая Б) Электронная В)
Молекулярная
Г) Структурная
Д) Углеродная
Слайд 8Вещества, имеющие одинаковый состав молекул (т.е. одну и ту же
молекулярную формулу),но различное химическое строение и обладающие поэтому разными свойствами: А)
Неорганические Б) Изомеры В) Простые Г) Газообразные Д) ЖидкиеСлайд 10Создатель теории химического строения органических веществ. А) А.Бутлеров Б) Ф. Кекуле В) В.
Марковников
Г) Д. Сокольский
Д) Н. Зинин
Слайд 22План урока
1.Дать понятие аминам. Строение и классификация аминов.
2.Ароматический амин-анилин. Строение,
свойство и получение.
Способы получения аминов
3.Свойство аминов. Сравнение свойств аминов с
аммиаком.4. Применение аминов.
5. Дать понятие аминокислотам. Строение, классификация, изомерия аминокислот.
6.Способы получения аминокислот.
7.Свойство аминокислот.
8.Применение аминокислот.
Слайд 23Амины-производные аммиака , в молекулах которого один или несколько атомов
водорода замещены углеводородными радикалами.
Слайд 25Амины классифицируются в зависимости от природы радикала , с которым
связана аминогруппа , на алифатические и ароматические. C2H5-NH2
C6H5-NH2 алифатический амин ароматический амин ( Этиламин ) ( Фениламин )Слайд 26По числу замещённых атомов водорода различают
Первичные- (Замещен один атом
водорода).
Вторичные- (Замещены два атома водорода из трех) . Третичные- (Замещены
три атома водорода из трех) амины. Четвертичная аммониевая соль вида [R4N]+Cl− является органическим аналогом аммониевой соли.
Первичный амин Вторичный амин Третичный амин
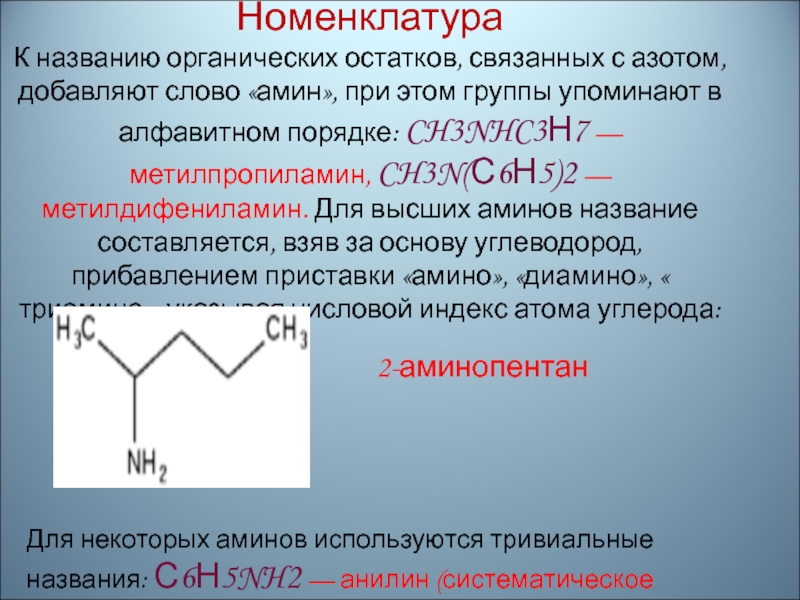
Слайд 29Номенклатура К названию органических остатков, связанных с азотом, добавляют слово «амин»,
при этом группы упоминают в алфавитном порядке: CH3NHC3Н7 — метилпропиламин,
CH3N(С6Н5)2 — метилдифениламин. Для высших аминов название составляется, взяв за основу углеводород, прибавлением приставки «амино», «диамино», « триамино», указывая числовой индекс атома углерода:2-аминопентан
Для некоторых аминов используются тривиальные названия: С6Н5NH2 — анилин (систематическое название — фениламин).
Слайд 30 Изомерия Структурная изомерия - углеродного скелета, начиная с С4H9NH2 - положения
аминогруппы, начиная с С3H7NH2 - изомерия аминогруппы, связанная с изменением
степени замещенности атомов водорода при азоте Пространственная изомерия Возможна оптическая изомерия, начиная с С4H9NH2Слайд 31
Изомерия углеродного скелета
Изомерия положения аминогруппы
пентиламин
2-пентиламин
3-пентиламинпентиламин 3-метилбутиламин 2-метилбутиламин
Слайд 32Получение аминов
В результате этой реакции образуется соль амина (гидробромид этиламмония),
из которой действием щёлочи можно выделить первичный амин (этиламин):
Получение аминов
из галогенопроизводных:Слайд 33При взаимодействии полученного первичного амина и галогенопроизводного и последующей обработке
щелочью получают вторичный амин (диэтиламин):
Слайд 35Третичный амин может ещё раз вступить в реакцию с бромэтаном.
При этом образуется четвертичная аммонийная соль, образованная бромид-ионом и катионом
тетраэтиламмония:Слайд 36Амины получают восстановлением нитросоединений в присутствии катализатора Sn/HCl, Fe/HCl, (NH4)2S, H2/Pt)
Слайд 37 Восстановлением азотсодержащих соединений: нитросоединений (реакция Зинина). Эту реакцию впервые осуществил Н.
Н. Зинин в 1842 году. Действуя на нитробензол сульфидом аммония,
он получил анилин: C6H5NO2 + 3(NH4)2S → C6H5NH2 + 6NH3 + 3S + 2H2O -Восстановлением нитрилов, оксимов, амидов. Алкилирование аммиака (реакция Гофмана)Слайд 38Физические свойства аминов При обычной температуре только низшие жирные амины CH3NH2,
(CH3)2NH, (CH3)3N – газы (с запахом аммиака), средние амины –
жидкости с резким запахом гниющей рыбы, высшие – твердые вещества без запаха. Амины способны к образованию водородных связей с водой. Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия к образованию водородных связей. Ароматические амины – бесцветные жидкости и твердые вещества с неприятным запахом, в воде практически не растворяются.Слайд 39Вредное воздействие Амины являются очень токсичными веществами. Опасно как вдыхание их
паров, так и контакт с кожей. Амины, например анилин, способны
всасываться сквозь кожу в кровь и нарушать функции гемоглобина, что может привести к летальному исходу. Симптомами отравления крови амином являются посинение кончиков пальцев, носа, губ, одышка, учащенное дыхание и сердцебиение, потеря сознания. В случае попадания амина на незащищенные участки кожи необходимо быстро и аккуратно, не увеличивая площадь поражения, очистить пораженный участок кожи ватой, смоченной в спирте. В случае отравления вывести пострадавшего на свежий воздух, обратиться к врачу.Слайд 40
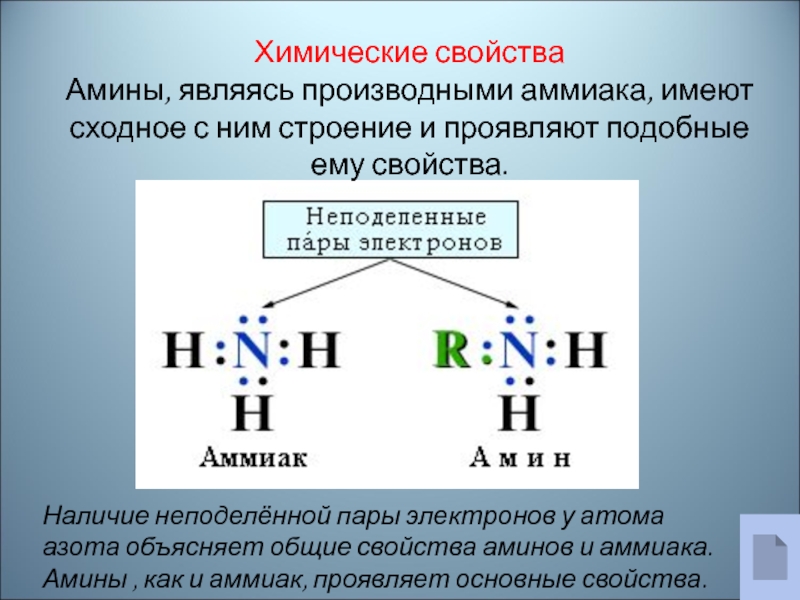
Наличие неподелённой пары электронов у атома азота объясняет общие свойства
аминов и аммиака. Амины , как и аммиак, проявляет основные
свойства.Химические свойства
Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства.
Слайд 42 Амины как основания
Атом азота аминогруппы
за счет неподеленной пары электронов может образовывать ковалентную связь по донорно – акцепторному механизму, вступая в роли донора. В связи с этим амины способны присоединять катион водорода. ИОН АММОНИЯ
ИОН ЭТИЛАММОНИЯ
Слайд 43-Первичные и вторичные амины взаимодействуют с азотистой кислотой различным образом.
При помощи азотистой кислоты первичные, вторичные и третичные амины отличают
друг от друга. Из первичных аминов образуются первичные спирты: C2H5NH2 + HNO2 → C2H5OH + N2 +H2O При этом выделяется газ (азот). Это признак того, что в колбе первичный амин. Вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины — соединения, содержащие фрагмент >N-N=O: (C2H5)2NH + HNO2 → (C2H5)2N-N=O + H2O Вторичные амины сложно не узнать, по лаборатории распространяется характерный запах нитрозодиметиламина. Третичные амины при обычной температуре в азотистой кислоте просто растворяются.Слайд 44 Амины способны окисляться с образованием различных продуктов, строение которых зависит
от типа амина и условий реакции. Например, при действии перманганата калия
на первичные ароматические амины образуются нитропроизводные аренов: KMnO4 С6H5NH2 + 3[O] ⎯⎯⎯→ С6H5NO2 + H2O анилин нитробензол Ароматические амины легко окисляются на воздухе, приобретая при этом темную окраску. Полное окисление аминов происходит при их горении: 4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2 ⇑ В отличие от аммиака, амины способны воспламеняться от открытого пламени.Слайд 46
Окисление анилина.
При окислении анилина образуются анилиновые красители.
Впервые анилиновый краситель
был получен английским химиком У.Г. Перкиным (1838-1907).
В 1856 году
при попытке окисления грязного анилина он получил мовеин.Окисление анилина хлорной известью (появление фиолетового цвета) используется для обнаружения анилина.
Слайд 47Применение
В настоящий момент в мире основная часть (85%) производимого анилина
используется для производства метилдиизоционатов (MDI), используемых затем для производства полиуретанов.
Анилин также используется при производстве искусственных каучуков (9%), гербицидов (2%) и красителей (2%).Он в основном применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты),
Амины широко применяются для получения лекарств, полимерных материалов.
Слайд 49
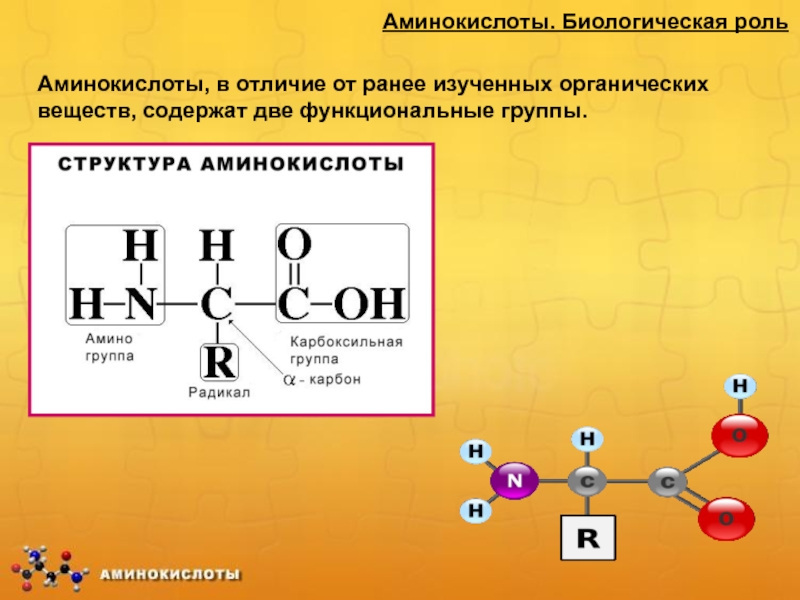
Аминокислоты – гетерофункциональные соединения, которые обязательно содержат две
функциональные группы: аминогруппу – NH2 и карбоксильную группу –COOH, связанные
с углеводородным радикалом Общая формула
Слайд 50Аминокислоты. Биологическая роль
Аминокислоты, в отличие от ранее изученных органических веществ,
содержат две функциональные группы.
Слайд 52*
Нижник Я.П. http://norgchem.professorjournal.ru
- По количеству карбокси- и аминогрупп
Моноаминомонокарбоновые кислоты
(глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, фенилаланин, тирозин,
метионин, триптофан и т.д.)Моноаминодикарбоновые кислоты (аспарагиновая кислота, глутаминовая кислота)
Диаминомонокарбоновые кислоты (лизин, аргинин)
Диаминодикарбоновые кислоты (цистин)
Слайд 53*
Нижник Я.П. http://norgchem.professorjournal.ru
-Классификация по встречаемости в белках
20 классических протеиногенных
аминокислот, информация о положении которых в белковой молекуле записана цифровым
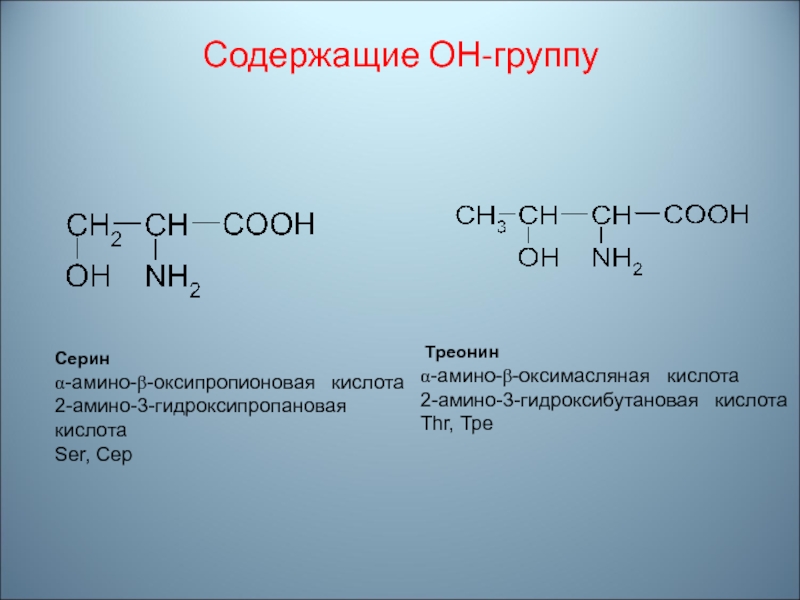
трёхбуквенным кодом в ДНК и РНКСлайд 55Содержащие ОН-группу
Ceрин
α-амино-β-оксипропионовая кислота
2-амино-3-гидроксипропановая кислота
Ser, Сeр
Трeонин
α-амино-β-оксимасляная
кислота
2-амино-3-гидроксибутановая кислота
Thr, Трe
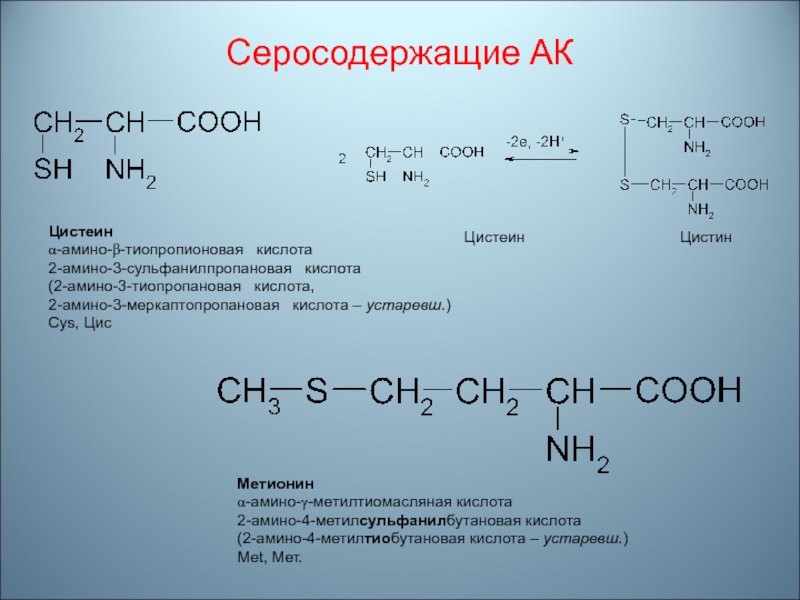
Слайд 56Серосодержащие АК
Цистеин
Цистин
Мeтионин
α-амино-γ-мeтилтиомасляная
кислота2-амино-4-метилсульфанилбутановая кислота
(2-амино-4-метилтиобутановая кислота – устаревш.)
Met, Мет.
Цистeин
α-амино-β-тиопропионовая кислота
2-амино-3-сульфанилпропановая кислота
(2-амино-3-тиопропановая кислота,
2-амино-3-мeркаптопропановая кислота – устаревш.)
Cys, Цис
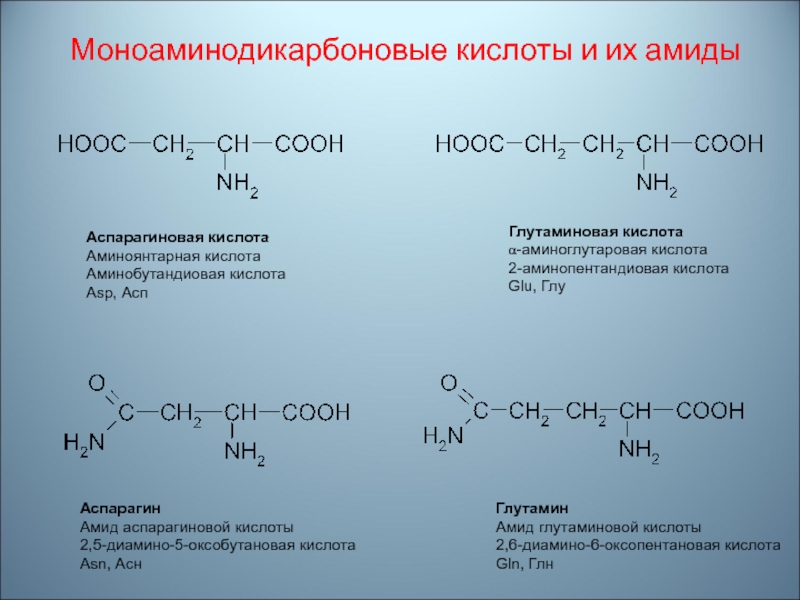
Слайд 57Моноаминодикарбоновые кислоты и их амиды
Аспарагиновая кислота
Аминоянтарная кислота
Аминобутандиовая кислота
Asp, Асп
Глутаминовая кислота
α-aминоглутаровая
кислота
2-аминопентандиовая кислота
Glu, Глу
Аспарагин
Амид аспарагиновой кислоты
2,5-диамино-5-оксобутановая кислота
Asn, Асн
Глутамин
Амид глутаминовой кислоты
2,6-диамино-6-оксопентановая кислота
Gln,
ГлнСлайд 58Содержащие аминогруппу
Лизин
α,ε-диаминокапроновая кислота
2,6-диаминогексановая кислота
Lys, Лиз
Аргинин
α-амино-δ-гуанидилвалериановая кислота
2-амино-5-[амино(имино)метил]аминопентановая к-та
Arg, Арг
Слайд 59Ароматические АК
Фенилаланин
α-амино-β-фенилпропионовая к-та
2-амино-3-фенилпропановая к-та
Phe, Фен
Тирозин
α-амино-β-(п-оксифенил)пропионовая к-та
2-амино-3-(4-гидроксифенил)пропановая к-та
Tyr, Тир
Слайд 60Гетероциклические АК
Триптофан
α-амино-β-индолилпропионовая к-та
2-амино-3-(1H-индол-3-ил)пропановая к-та
Trp, Три
Гистидин
α-амино-β-имидазолилпропионовая к-та
2-амино-3-(1H-имидазол-4-ил)пропионовая к-та
His, Гис
Пролин
Пирролидин-α-карбоновая к-та
2-пирролидинкарбоновая к-та
Pro,
Про
Для сравнения- аланин
Слайд 61
По пищевой ценности для
человека
Аминокислоты делятся на
заменимые и незаменимые
К незаменимым аминокислотам относят:
валин, изолейцин, лейцин, триптофан, фенилаланин, метионин, лизин, треонин.Слайд 62Изомерия аминокислот выражается:
1. Различным строением углеродной цепи
CH3
– CH2 – CH – C
NH2
Изомерия и номенклатура:
O
OH
CH2 – CH2 – CH2 – C
NH2
4-АМИНОБУТАНОВАЯ КИСЛОТА
O
OH
2-АМИНОБУТАНОВАЯ КИСЛОТА
CH3 – C – C
NH2
O
OH
сн3
2-АМИНО-2-МЕТИЛПРОПАНОВАЯ КИСЛОТА
CH3 – CH2 – CH – C
NH2
O
OH
2-АМИНОБУТАНОВАЯ КИСЛОТА
2.Положением аминогруппы
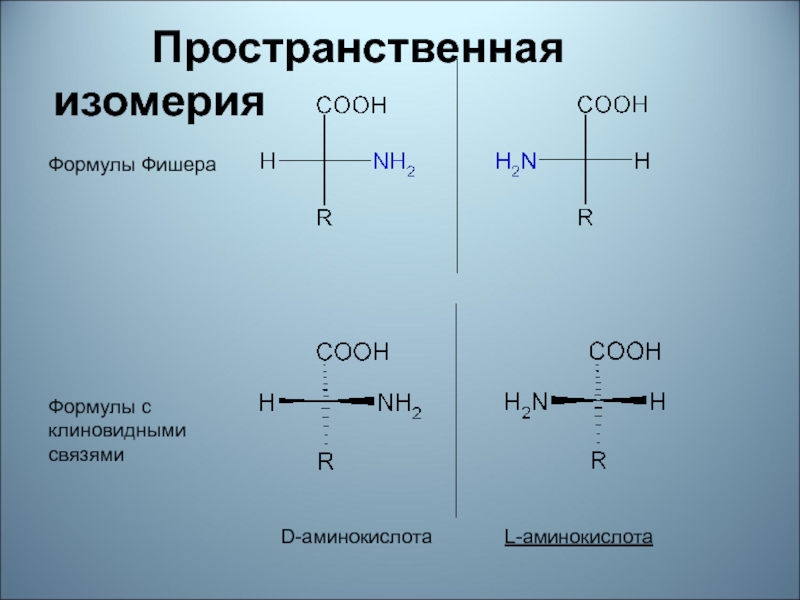
Слайд 63
Пространственная изомерия
D-аминокислота L-аминокислота
Формулы Фишера
Формулы
с клиновидными
связями
Слайд 64
Номенклатура
Тривиальная номенклатура в основном используется для
широко распространённых аминокислот.Рациональная и IUPAC
α-амино-β-гидроксипропионовая кислота
2-амино-3-гидроксипропановая кислота
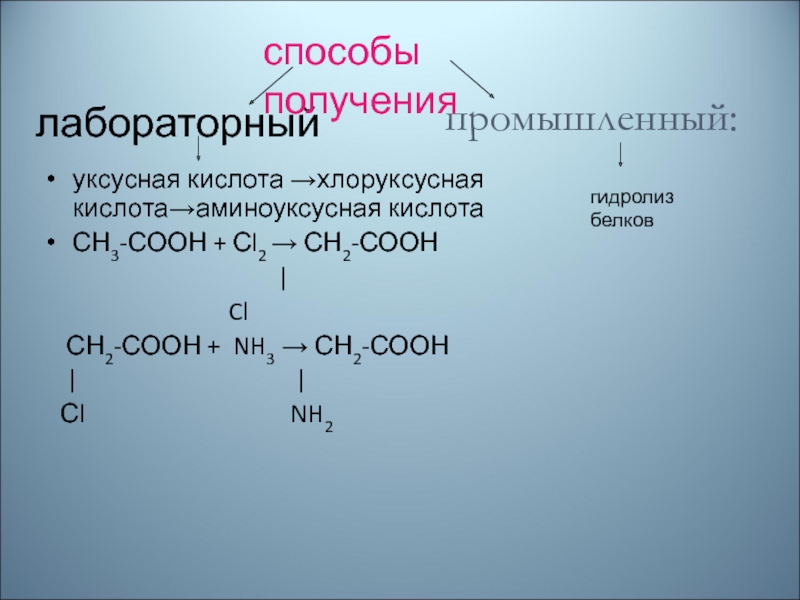
Слайд 65лабораторный
уксусная кислота →хлоруксусная кислота→аминоуксусная кислота
СН3-СООН + Сl2 → СН2-СООН
|
Cl
СН2-СООН + NH3 → СН2-СООН
| |
Сl NH2
способы получения
гидролиз белков
промышленный:
Слайд 66
Физические свойства
Аминокислоты, как правило, являются бесцветными кристаллическими соединениями. Большинство
из них умеренно растворимы в воде.
сладкие,
безвкусные, горькие Почему?
Вывод: зависит от радикала
Слайд 67Химические свойства:
1) Растворимость в воде (атом водорода карбоксильной группы переходит
к аминогруппе и образуются биполярные ионы)
N+H2 –
CH – COOH N+H3 – CH – COO - | |
R R
2) С кислотами
NH2 – CH2 – COOH + НС| → [NH3 – CH2 – COOH ] С| гидрохлорид глицина
как основание
3) С основаниями
NH2 – CH2 – COOH + Na OH → NH2 – CH2 – COONa + H2O
как кислота
Вывод : органические амфотерные соединения
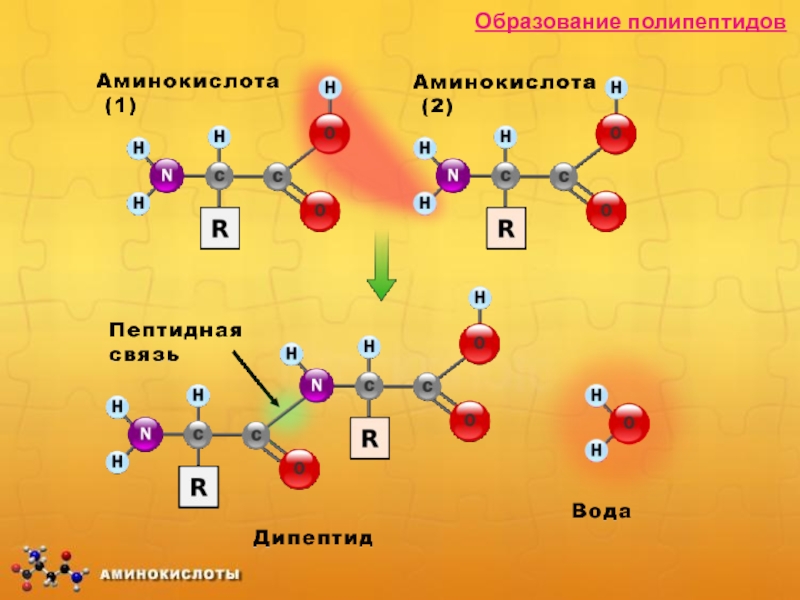
4) Специфическое - взаимодействие между собой
NH2 – CH2 – COOH + НNH – CH2 – COOH → NH2 – CH2 – CO- NH – CH2 –COOH
пептидная
связь
Вывод:
α-аминокислоты – элементарные частицы природных полимеров- белков
Биполярный ион
Слайд 70В живых организмах:
Природные аминокислоты (около 150)
Протеиногенные аминокислоты (около 20) в
белках
Незаменимые:
валин, лейцин, лизин, треонин, цистеин и др.
Антибиотики (пенициллин)
Полиамидные смолы
(капрон, нейлон)*Добавка к корму
Слайд 878. Русский химик-органик, который открыл реакцию восстановления ароматических нитросоединений и
получил анилин
Слайд 93Словарь химических терминов:
Амины – Аминдер- Amines азотсодержащие органические соединения, производные
аммиака, в молекуле которого один или несколько атомов водорода замещены
на углеводородный радикал.Аминокислоты - Аминқышқылдар - Amino Acids азотсодержащие органические соединения, в молекуле которых содержатся аминогруппа и карбоксильная группа.
Азотсодержащие соединения – Құрамында азоты бар қосылыстар - Nitrogen compounds органические соединения, функциональная группа которых содержит атом азота.
Аминогруппа – Амин тобы - The amino group группа атомов NH2










































![Амины. Аминокислоты. Содержащие аминогруппуЛизинα,ε-диаминокапроновая кислота2,6-диаминогексановая кислотаLys, ЛизАргининα-амино-δ-гуанидилвалериановая кислота2-амино-5-[амино(имино)метил]аминопентановая к-таArg, Арг Содержащие аминогруппуЛизинα,ε-диаминокапроновая кислота2,6-диаминогексановая кислотаLys, ЛизАргининα-амино-δ-гуанидилвалериановая кислота2-амино-5-[амино(имино)метил]аминопентановая к-таArg, Арг](/img/thumbs/d3be6afdf9d9803f772a36afd9991ca8-800x.jpg)