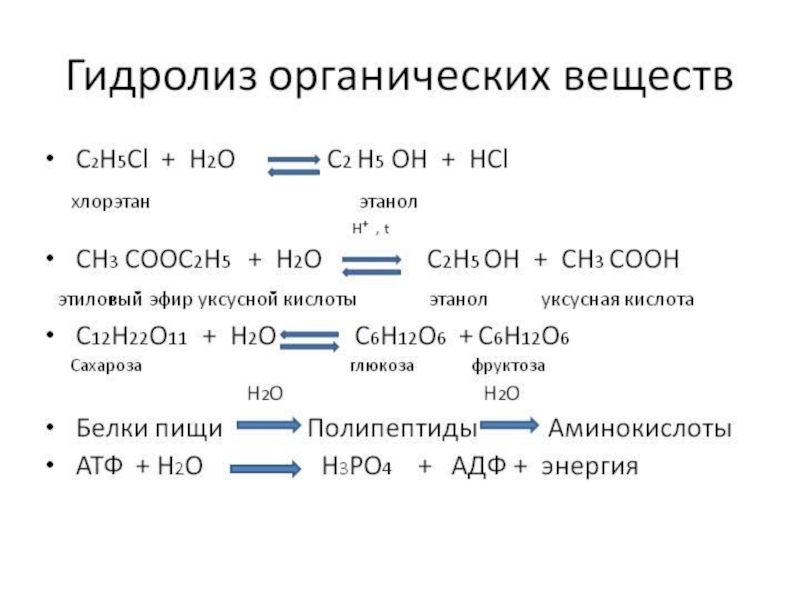
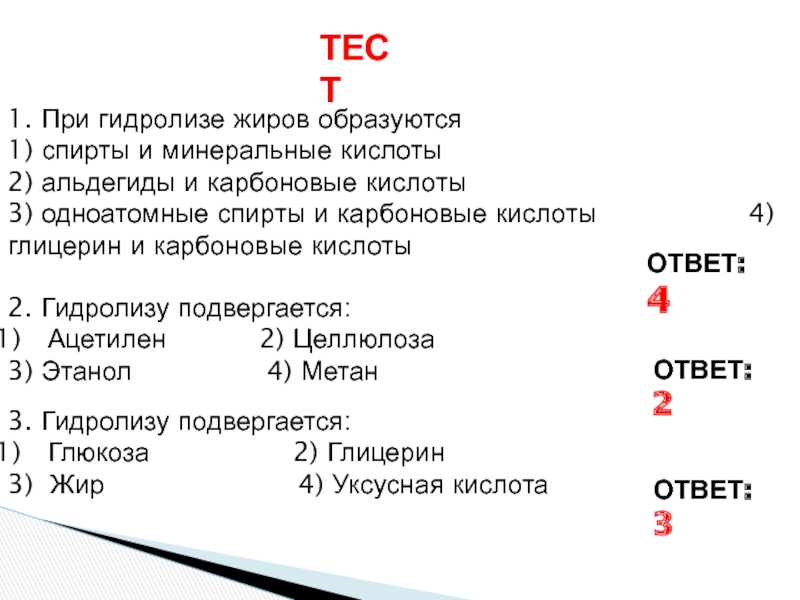
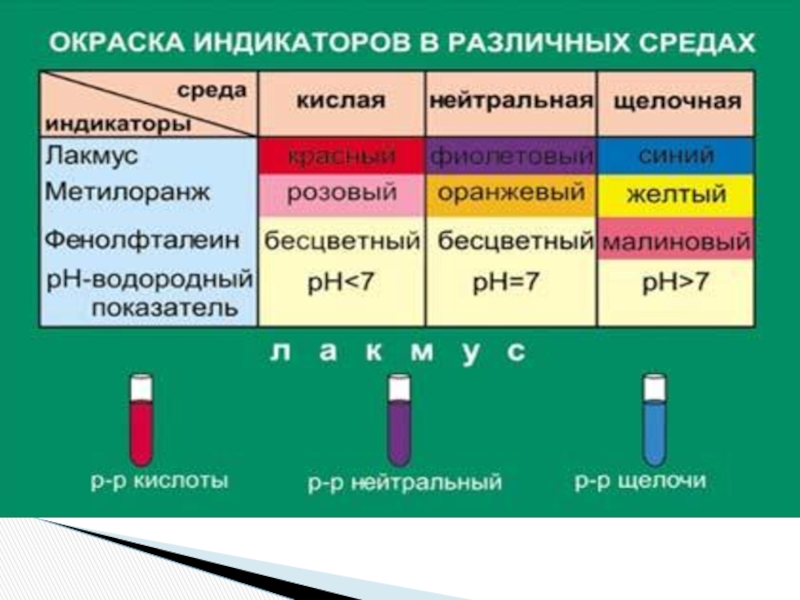
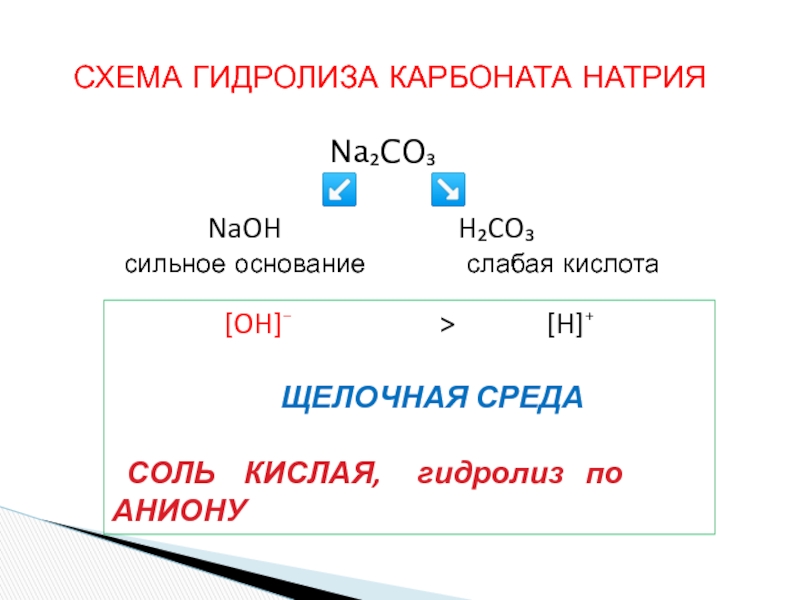
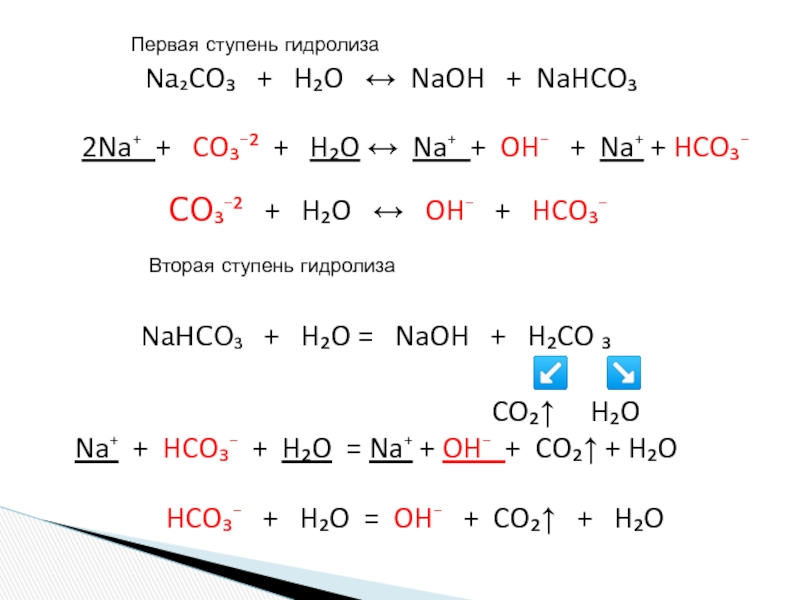
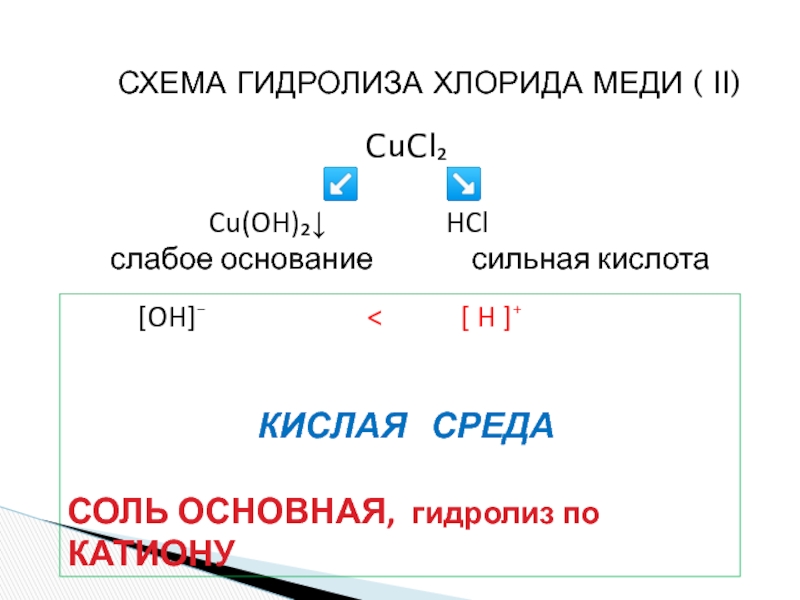
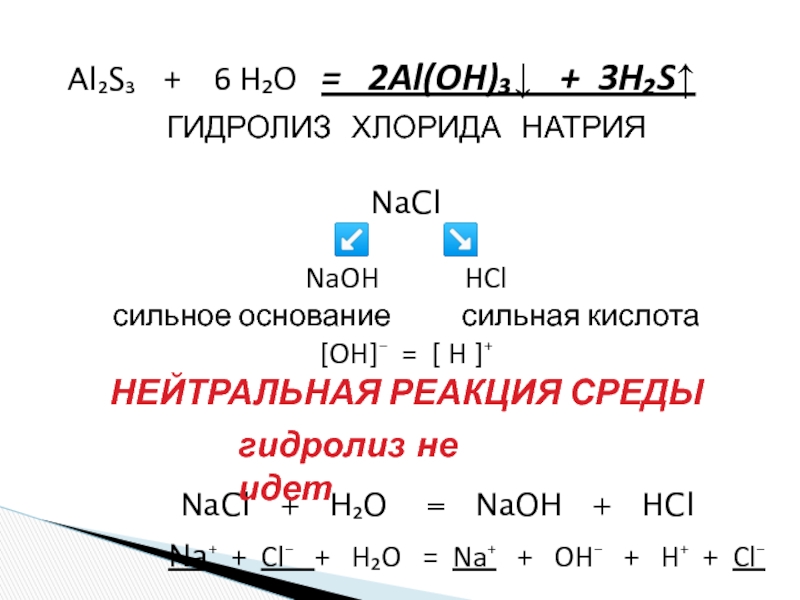
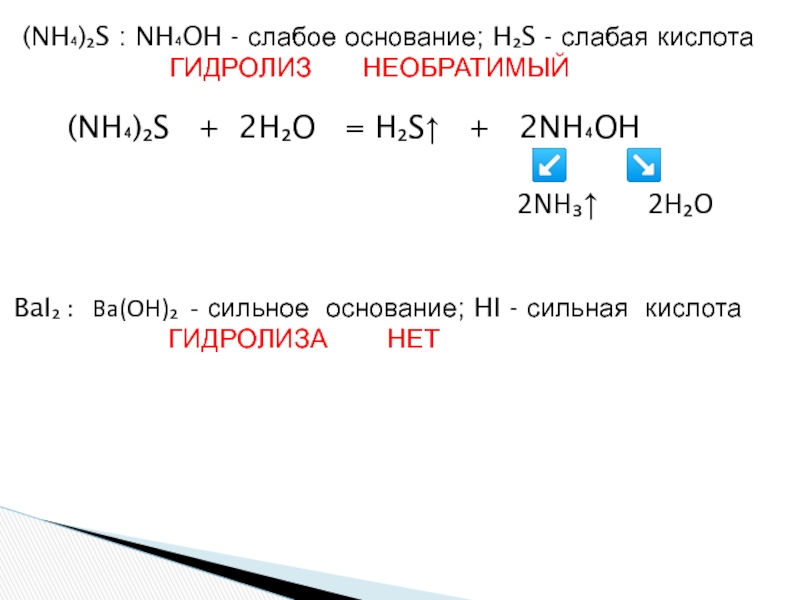
«λύσις» — разложение)
— один из видов химических реакций, где при взаимодействии
веществ с водой происходит разложение исходного вещества с образованием новых соединений.Механизм гидролиза соединений различных классов:
- соли, углеводы, жиры, сложные эфиры и др. имеет существенные различия