Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химический тренажер "Вопросы ЕГЭ по химии различного уровня"
Содержание
- 1. Химический тренажер "Вопросы ЕГЭ по химии различного уровня"
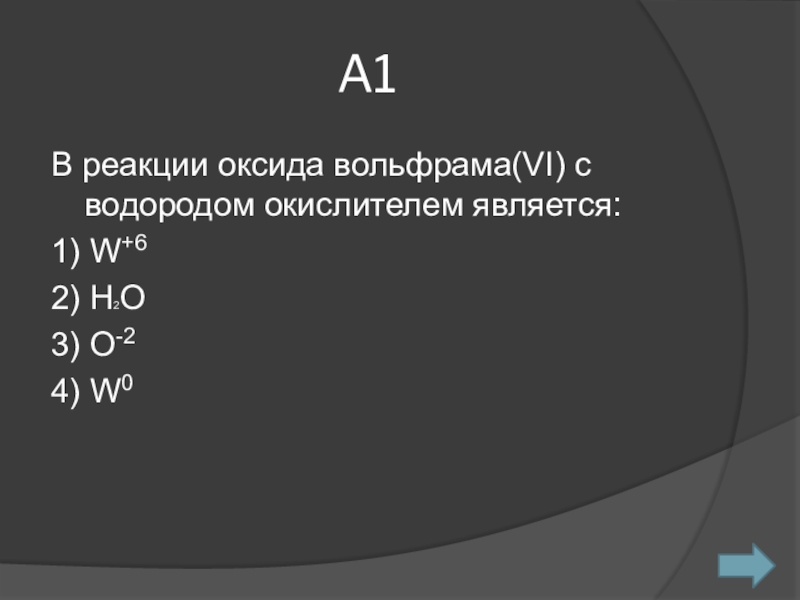
- 2. A1В реакции оксида вольфрама(VI) с водородом окислителем является:1) W+62) H2O3) O-24) W0
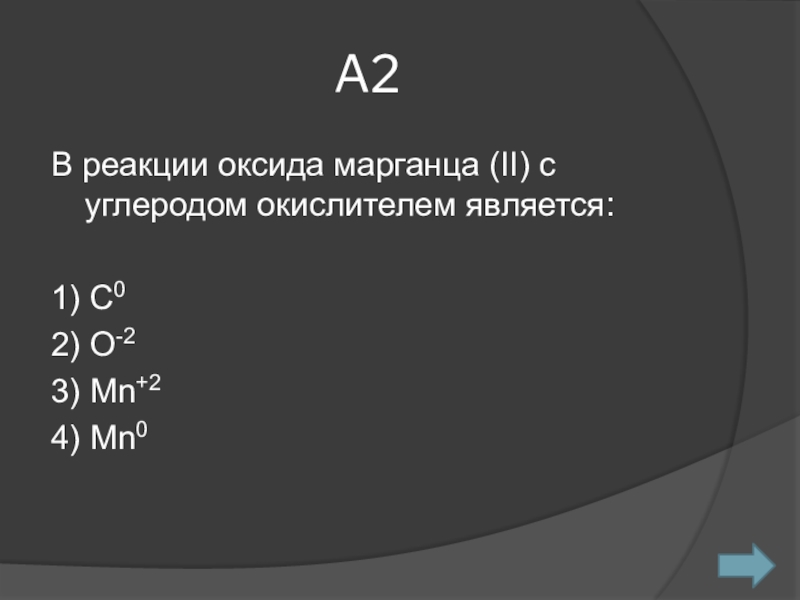
- 3. A2В реакции оксида марганца (II) c углеродом окислителем является:1) С02) О-23) Mn+24) Mn0
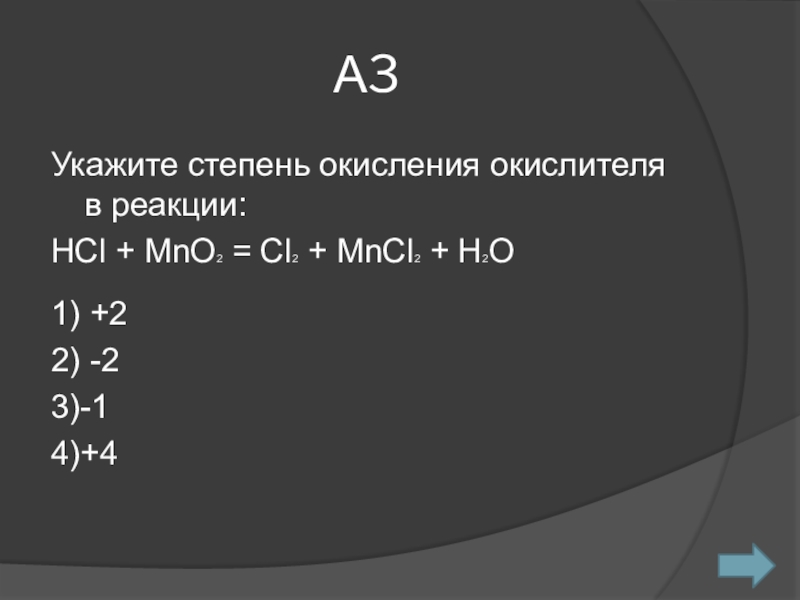
- 4. А3Укажите степень окисления окислителя в реакции:НCl + MnO2 = Cl2 + MnCl2 + H2O1) +22) -23)-14)+4
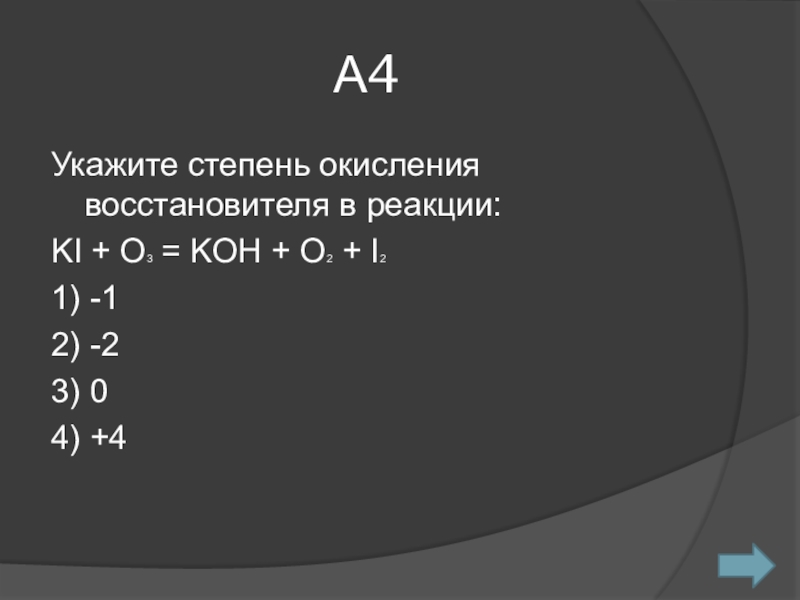
- 5. А4Укажите степень окисления восстановителя в реакции:KI +
- 6. A5Коэффициент перед формулой окислителя в уравнении реакции
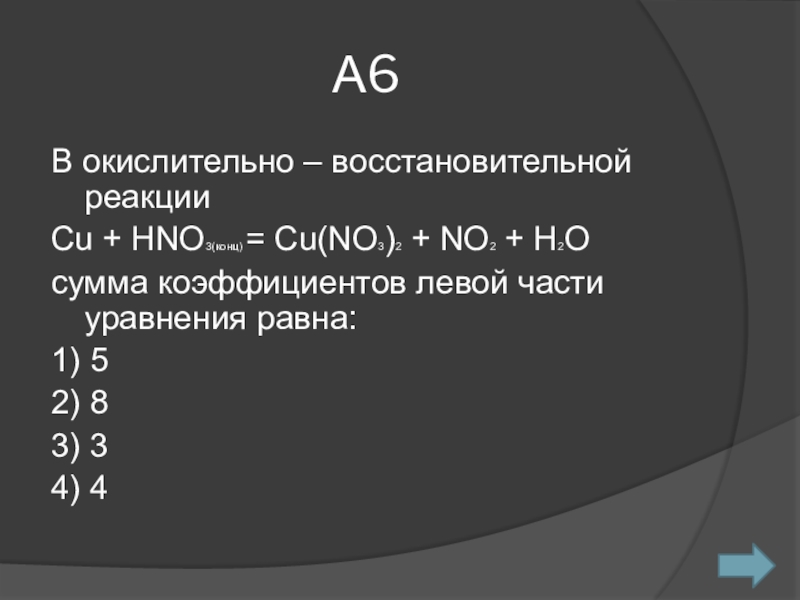
- 7. А6В окислительно – восстановительной реакцииСu + HNO3(конц)
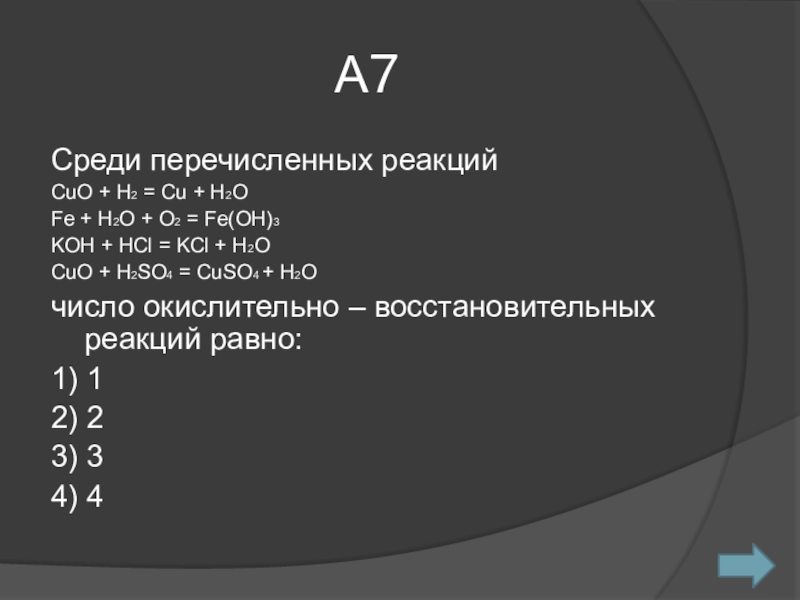
- 8. А7Среди перечисленных реакцийСuO + H2 = Cu
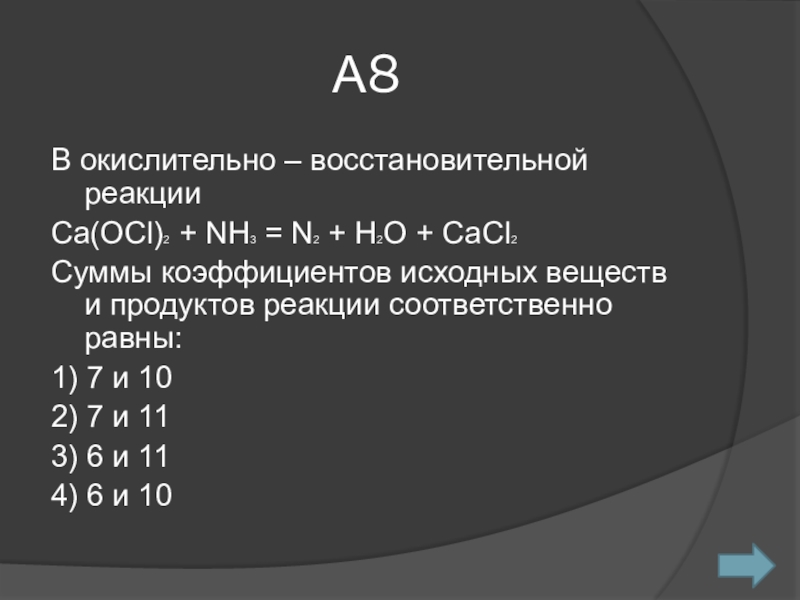
- 9. А8В окислительно – восстановительной реакции Сa(OCl)2 +
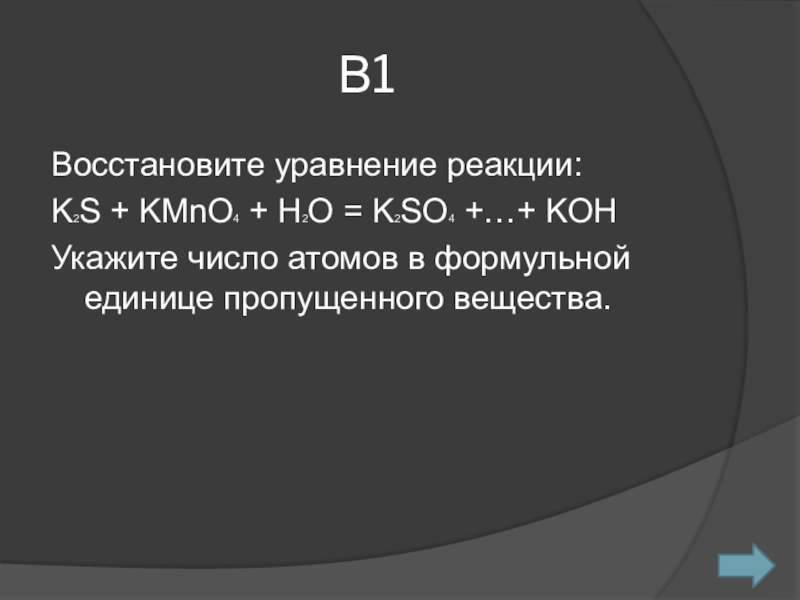
- 10. В1Восстановите уравнение реакции:K2S + KMnO4 + H2O
- 11. В2Подберите коэффициенты методом электронного баланса в уравнении:
- 12. В3В уравнении окислительно – восстановительной реакции расставьте
- 13. В4В уравнении окислительно – восстановительной реакции расставьте
- 14. С1Используя метод электронного баланса, составьте уравнение реакции:Cr2(SO4)3
- 15. С2Используя метод электронного баланса, составьте уравнение реакции:KMnO4
- 16. С3Используя метод электронного баланса, составьте уравнение реакции:KMnO4
- 17. С4Используя метод электронного баланса, составьте уравнение реакции:H2S + HMnO4 = S + MnO2 + … .
- 18. С5Составьте уравнение окислительно – восстановительных реакций:FeSO4 + KClO3 + H2SO4 = …
- 19. С6Составьте уравнение окислительно – восстановительных реакций:KMnO4 + H2O2 + H2SO4 =
- 20. С7Составьте уравнение окислительно – восстановительных реакций:K2Cr2O7 + CH3OH + H2SO4 =
- 21. С8Составьте уравнение окислительно – восстановительных реакций:MnO2 + H2C2O4 + H2SO4 =
- 22. Скачать презентанцию
A1В реакции оксида вольфрама(VI) с водородом окислителем является:1) W+62) H2O3) O-24) W0
Слайды и текст этой презентации
Слайд 1А1
(1 балл)
A2
(1 балл)
А3
(1 балл)
А4
(1 балл)
А5
(2 балла)
А6
(2 балла)
А7
(2 балла)
А8
(2 балла)
В4
(3 балла)
В3
(3
балла)
баллов)Слайд 4А3
Укажите степень окисления окислителя в реакции:
НCl + MnO2 = Cl2
+ MnCl2 + H2O
1) +2
2) -2
3)-1
4)+4
Слайд 5А4
Укажите степень окисления восстановителя в реакции:
KI + O3 = KOH
+ O2 + I2
1) -1
2) -2
3) 0
4) +4
Слайд 6A5
Коэффициент перед формулой окислителя в уравнении реакции равен:
NH3 + O2
= NO + H2O
1) 1
2) 2
3) 3
4) 5
Слайд 7А6
В окислительно – восстановительной реакции
Сu + HNO3(конц) = Cu(NO3)2 +
NO2 + H2O
сумма коэффициентов левой части уравнения равна:
1) 5
2) 8
3)
34) 4
Слайд 8А7
Среди перечисленных реакций
СuO + H2 = Cu + H2O
Fe +
H2O + O2 = Fe(OH)3
KOH + HCl = KCl
+ H2OCuO + H2SO4 = CuSO4 + H2O
число окислительно – восстановительных реакций равно:
1) 1
2) 2
3) 3
4) 4
Слайд 9А8
В окислительно – восстановительной реакции
Сa(OCl)2 + NH3 = N2
+ H2O + CaCl2
Суммы коэффициентов исходных веществ и продуктов реакции
соответственно равны:1) 7 и 10
2) 7 и 11
3) 6 и 11
4) 6 и 10
Слайд 10В1
Восстановите уравнение реакции:
K2S + KMnO4 + H2O = K2SO4 +…+
KOH
Укажите число атомов в формульной единице пропущенного вещества.
Слайд 11В2
Подберите коэффициенты методом электронного баланса в уравнении:
К2Сr2O7 + SO2
+ H2SO4 = K2SO4 + Cr2(SO4)3 + + H2O
Укажите коэффициент,
стоящий в суммарном уравнении перед восстановителем.Слайд 12В3
В уравнении окислительно – восстановительной реакции расставьте коэффициенты любым известным
вам способом. Укажите названия вещества – окислителя и вещества –
восстановителя и степени окисления элементов:PH3 + KMnO4 + HCl = H3PO4 + KCl + MnCl2 + H2O
Слайд 13В4
В уравнении окислительно – восстановительной реакции расставьте коэффициенты любым известным
вам способом. Укажите названия вещества – окислителя и вещества –
восстановителя и степени окисления элементов:H2O + K2S + K2MnO4 = S + MnO2 + KOH
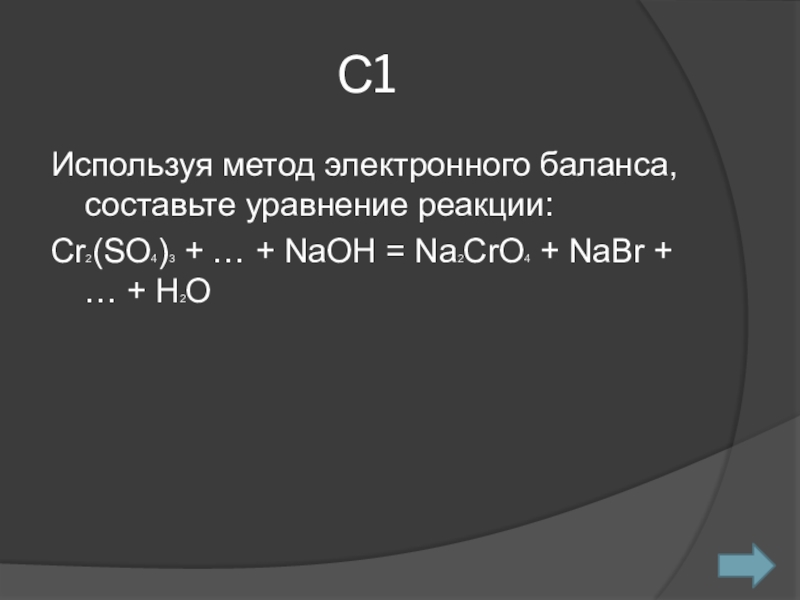
Слайд 14С1
Используя метод электронного баланса, составьте уравнение реакции:
Cr2(SO4)3 + … +
NaOH = Na2CrO4 + NaBr + … + H2O
Слайд 15С2
Используя метод электронного баланса, составьте уравнение реакции:
KMnO4 + H2S +
H2SO4 = MnSO4 + S + … + + …
.Слайд 16С3
Используя метод электронного баланса, составьте уравнение реакции:
KMnO4 + KBr +
H2SO4 = MnSO4 + Br2 + … + … .
Слайд 17С4
Используя метод электронного баланса, составьте уравнение реакции:
H2S + HMnO4 =
S + MnO2 + … .
Слайд 19С6
Составьте уравнение окислительно – восстановительных реакций:
KMnO4 + H2O2 + H2SO4
=
Обратная связь
Если не удалось найти и скачать доклад-презентацию, Вы можете заказать его на нашем сайте. Мы постараемся найти нужный Вам материал и отправим по электронной почте. Не стесняйтесь обращаться к нам, если у вас возникли вопросы или пожелания:
Email: Нажмите что бы посмотреть