Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Водород 10 класс
Содержание
- 1. Водород 10 класс
- 2. Атом водорода (лат. Hydrogenium) состоит из ядра,
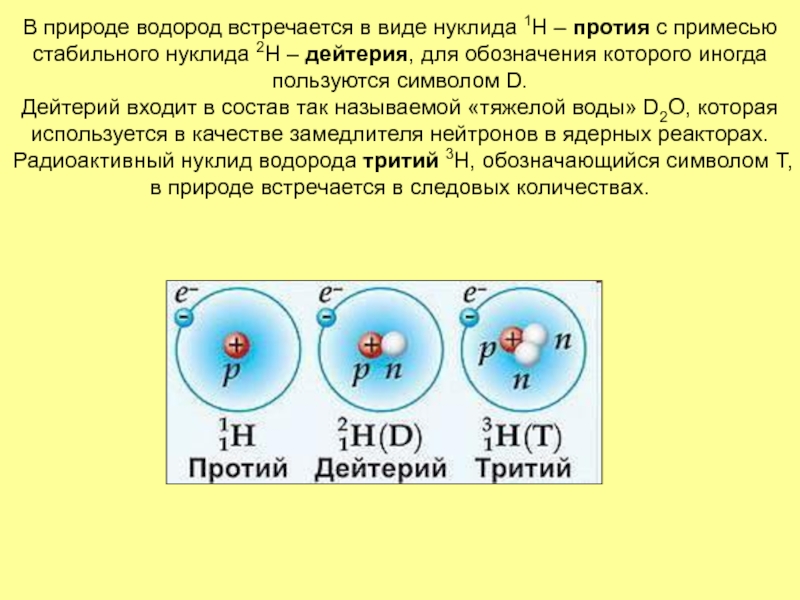
- 3. В природе водород встречается в виде нуклида
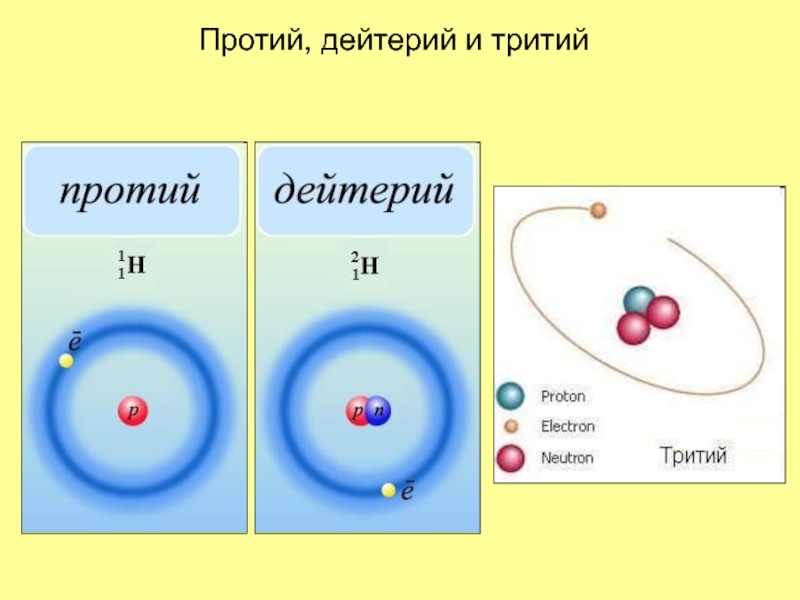
- 4. Протий, дейтерий и тритий
- 5. Атом водорода в соединениях с более электроотрицательными
- 6. Распространенность в космосе Во Вселенной водород является самым
- 7. Распространенность на ЗемлеСреди элементов, существующих на Земле,
- 8. Простое веществоМолекула водорода состоит из двух атомов,
- 9. Молекула водорода неполярна. Поэтому силы межмолекулярного взаимодействия
- 10. Получение водорода В лаборатории водород чаще всего получают
- 11. Взаимодействие водорода с простыми веществамиВодород как восстановитель
- 12. Соединения водорода с галогенами – HF, HCl,
- 13. Окислительная способность водорода проявляется при взаимодействии его
- 14. Взаимодействие водорода со сложными веществами При нагревании водород
- 15. Применение водородаВодород очень лёгок и в воздухе
- 16. Домашнее задание: Параграф §42.
- 17. Список используемых источниковhttp://ru.wikipedia.org/wiki/Водородhttp://energycraft.ru/Vodorod/neft-ili-vodorod.htmlhttp://mozgochiny.ru/himiya/poluchenie-vodoroda-tremya-sposobami/http://www.wikiznanie.ru/ru-wz/index.php/Водородhttp://vodorod.16mb.com/fiz_svoistva.phphttp://justwater.ru/wp-content/uploads/2009/12/tritij-izotop-vodoroda.jpghttp://tarelohca.ru/wp-content/uploads/2012/09/1302678491_space__001606_1.jpg
- 18. Скачать презентанцию
Атом водорода (лат. Hydrogenium) состоит из ядра, содержащего один протон, и одного электрона на окружающей ядро орбитали. Такое строение внешнего электронного слоя характерно для элементов IA-группы, поэтому водород можно отнести к
Слайды и текст этой презентации
Слайд 2Атом водорода (лат. Hydrogenium) состоит из ядра, содержащего один протон,
и одного электрона на окружающей ядро орбитали. Такое строение внешнего
электронного слоя характерно для элементов IA-группы, поэтому водород можно отнести к элементам этой группы. Одновременно водород можно отнести и к элементам VIIA-группы, поскольку так же, как и у элементов данной группы, для завершения внешнего электронного слоя у него не хватает одного электрона.Слайд 3В природе водород встречается в виде нуклида 1Н – протия
с примесью стабильного нуклида 2Н – дейтерия, для обозначения которого
иногда пользуются символом D. Дейтерий входит в состав так называемой «тяжелой воды» D2O, которая используется в качестве замедлителя нейтронов в ядерных реакторах. Радиоактивный нуклид водорода тритий 3Н, обозначающийся символом T, в природе встречается в следовых количествах.Слайд 5Атом водорода в соединениях с более электроотрицательными элементами проявляет степени
окисления +1, например HF, H2O и др. А в соединениях
с металлами (гидридах) степень окисления атома водорода равна -1, например NaH, CaH2 и др.HF
NaH
Слайд 6Распространенность в космосе
Во Вселенной водород является самым распространенным элементом. На
долю этого элемента приходится около 75% массы Вселенной.
Он входит
в состав Солнца и многих других звезд, туманностей. Планеты Юпитер и Сатурн в основном состоят из водорода.Слайд 7Распространенность на Земле
Среди элементов, существующих на Земле, водород – 9ый
по распространенности. Наиболее важным его соединением, встречающимся в природе, является
вода.Водород входит в состав природного газа, нефти, а также всех животных и растительных организмов. В виде простого вещества водород встречается крайне редко в вулканических газах.
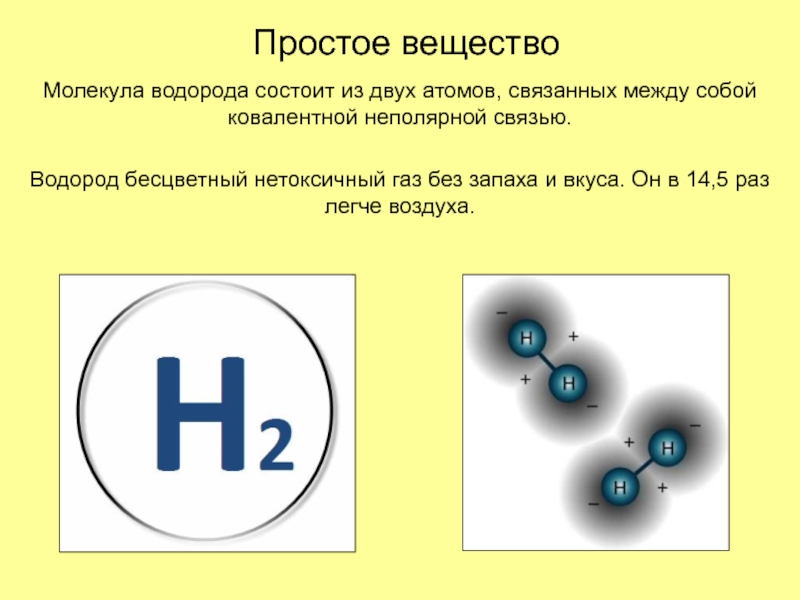
Слайд 8Простое вещество
Молекула водорода состоит из двух атомов, связанных между собой
ковалентной неполярной связью.
Водород бесцветный нетоксичный газ без запаха и вкуса.
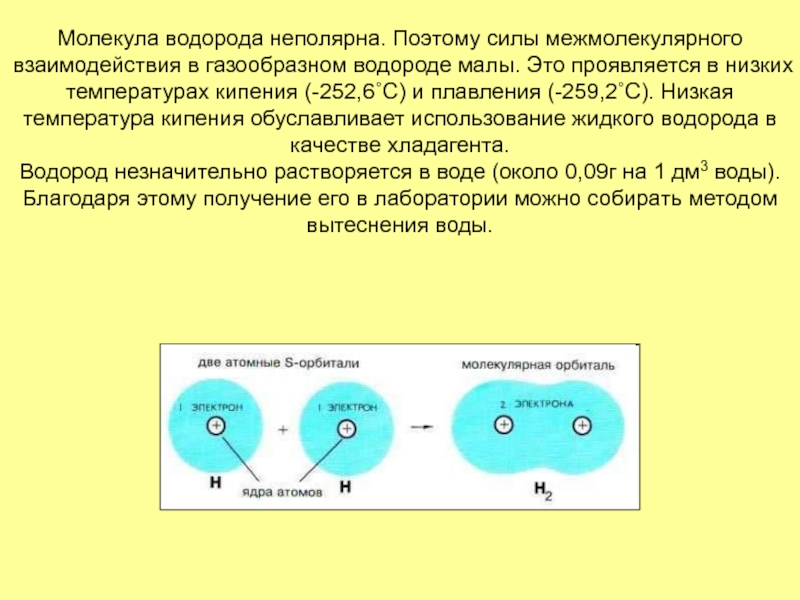
Он в 14,5 раз легче воздуха.Слайд 9Молекула водорода неполярна. Поэтому силы межмолекулярного взаимодействия в газообразном водороде
малы. Это проявляется в низких температурах кипения (-252,6˚С) и плавления
(-259,2˚С). Низкая температура кипения обуславливает использование жидкого водорода в качестве хладагента. Водород незначительно растворяется в воде (около 0,09г на 1 дм3 воды). Благодаря этому получение его в лаборатории можно собирать методом вытеснения воды.Слайд 10Получение водорода
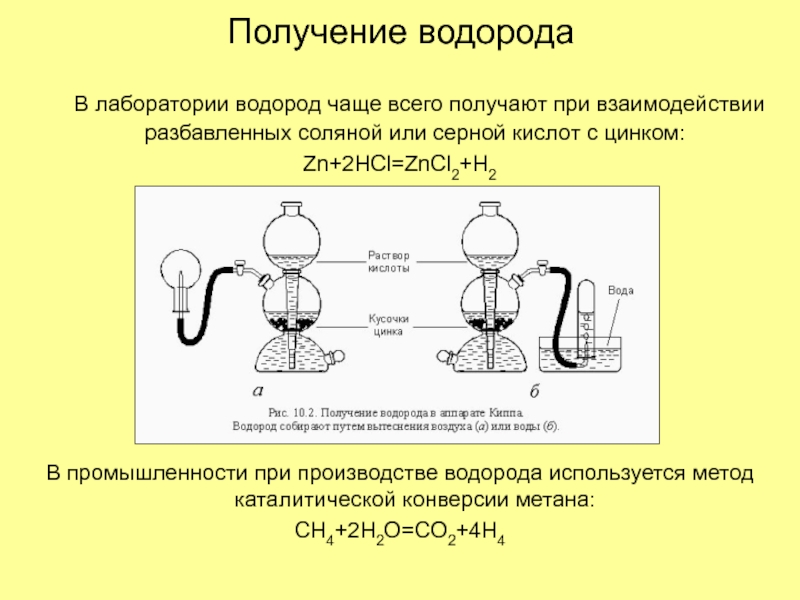
В лаборатории водород чаще всего получают при взаимодействии разбавленных
соляной или серной кислот с цинком:
Zn+2HCl=ZnCl2+H2
В промышленности при производстве водорода
используется метод каталитической конверсии метана:CH4+2H2O=CO2+4H4
Слайд 11Взаимодействие водорода с простыми веществами
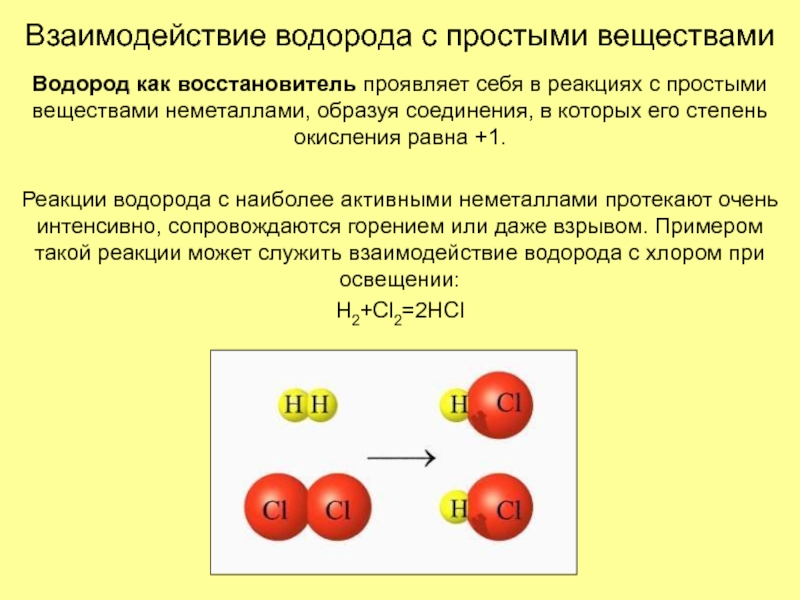
Водород как восстановитель проявляет себя в
реакциях с простыми веществами неметаллами, образуя соединения, в которых его
степень окисления равна +1.Реакции водорода с наиболее активными неметаллами протекают очень интенсивно, сопровождаются горением или даже взрывом. Примером такой реакции может служить взаимодействие водорода с хлором при освещении:
H2+Cl2=2HCl
Слайд 12Соединения водорода с галогенами – HF, HCl, HBr, HI –
при растворении в воде диссоциируют с образованием гидратированных ионов водорода,
т.е. проявляют кислотный характер, например: HCl→H++Cl- С азотом водород взаимодействует в присутствии катализатора при повышенных температуре и давлении, образуя аммиак: 3H2+N2↔2NH3 Раствор аммиака в воде проявляет основные свойства.Слайд 13Окислительная способность водорода проявляется при взаимодействии его со многими активными
металлами при повышенных температуре и давлении. В результате реакций образуются
гидриды, в которых степень окисления водорода равна -1, например: 2Li+H2=2LiH Гидриды щелочных металлов легко разлагаются водой, в результате реакции образуются щелочь и водород: NaH+H2O=NaOH+H2NaOH
Слайд 14Взаимодействие водорода со сложными веществами
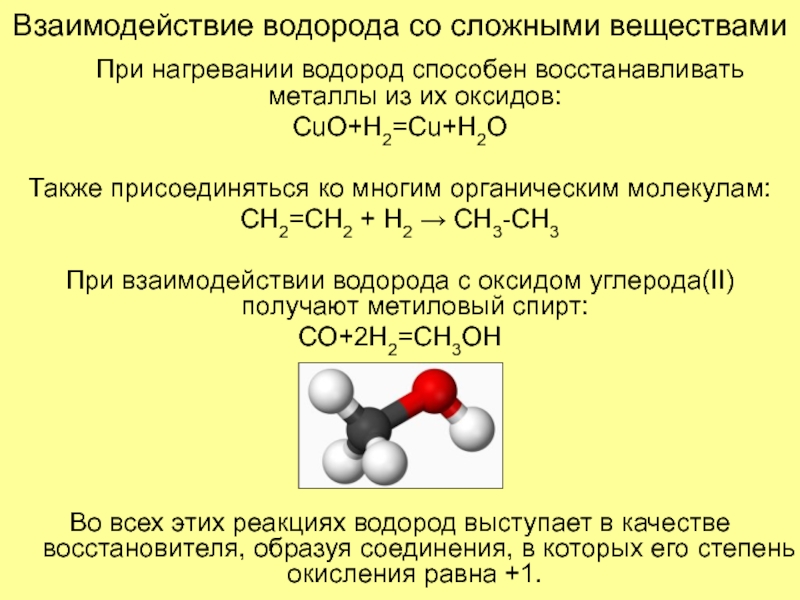
При нагревании водород способен восстанавливать металлы
из их оксидов:
CuO+H2=Cu+H2O
Также присоединяться ко многим органическим молекулам:
CH2=CH2 + H2
→ CH3-CH3При взаимодействии водорода с оксидом углерода(II) получают метиловый спирт:
CO+2H2=CH3OH
Во всех этих реакциях водород выступает в качестве восстановителя, образуя соединения, в которых его степень окисления равна +1.
Слайд 15Применение водорода
Водород очень лёгок и в воздухе всегда поднимается вверх.
Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х
гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали (водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ.)В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Водород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей.