Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация к уроку химии "Соединения серы", 9 класс
Содержание
- 1. Презентация к уроку химии "Соединения серы", 9 класс
- 2. степень окисления серы -2
- 3. Н2SСЕРОВОДОРОД Встречается в природе в составе нефти,
- 4. СТРОЕНИЕ МОЛЕКУЛЫМолекула сероводорода имеет угловую форму, поэтому
- 5. ФИЗИЧЕСКИЕ СВОЙСТВАядовитый газ тяжелее воздуха с неприятным
- 6. ПОЛУЧЕНИЕВ лаборатории обычно получают действием разбавленных кислот
- 7. ХИМИЧЕСКИЕ СВОЙСТВАСероводород — сильный восстановитель. сгорание
- 8. ХИМИЧЕСКИЕ СВОЙСТВАВ воде сероводород мало растворим, водный
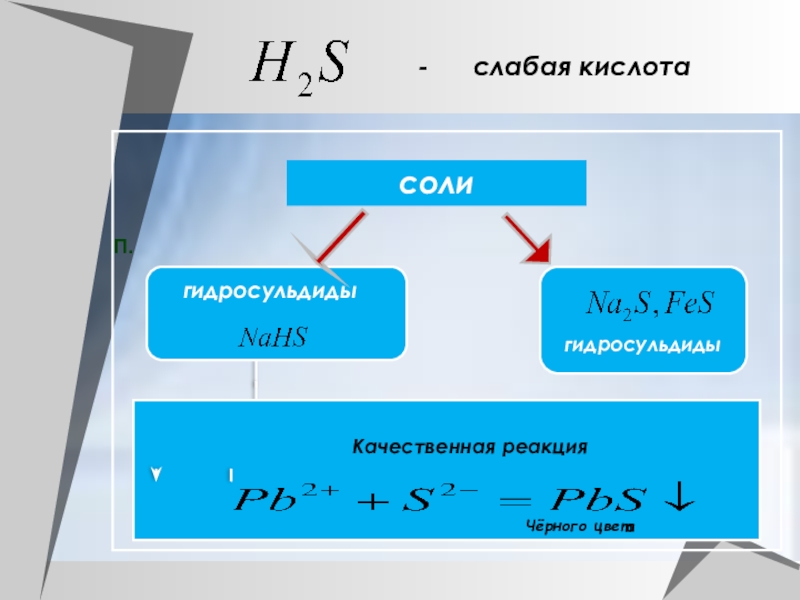
- 9. П.солигидросульдидыгидросульдидыКачественная реакция Чёрного цвета- слабая кислота
- 10. ПРИМЕНЕНИЕСероводород из-за своей токсичности находит ограниченное применение.В
- 11. степень окисления серы + 4
- 12. СЕРНИСТЫЙ ГАЗSO2Нахождение в природеОксид серы (lV) –
- 13. СТРОЕНИЕ МОЛЕКУЛЫ
- 14. ПОЛУЧЕНИЕВ промышленности: обжиг сульфидов:4FeS2 + 11O2 →
- 15. ФИЗИЧЕСКИЕ СВОЙСТВАбесцветный газ с характерным резким удушливым
- 16. Химические свойства оксида серы (IV)Относится к
- 17. Химические свойства оксида серы (IV)Данная реакция
- 18. Оксид серы (IV) ПРИМЕНЕНИЕ
- 19. Сернистая кислота H2SO3 Неустойчивая двухосновная кислотакислота средней
- 20. Соли ее – сульфиты, растворимые из них
- 21. Применение сернистой кислоты H2SO3 Сернистая кислота и
- 22. степень окисления серы + 6
- 23. Оксид серы (VI) СТРОЕНИЕ МОЛЕКУЛЫSO3 — высший оксид серы, тип химической связи: ковалентная полярная
- 24. Оксид серы (VI) Физические свойстваВ обычных условиях
- 25. ХИМИЧЕСКИЕ СВОЙСТВАПроявляет только свойства окислителя:3SO3 + H2S
- 26. ОКИСЛИТЕЛЬНО- ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА SO3 характеризуется сильными окислительными
- 27. в качестве растворителя в лабораториях;в текстильной промышленности
- 28. Серная кислота Н2SO4
- 29. Вулкан Малый Семячик Вулканический хребет длиной около 3
- 30. Физические свойства серной кислоты.Безводная серная кислота -
- 31. Техника безопасности при работе с серной кислотойСерная
- 32. ХИМИЧЕСКИЕ СВОЙСТВАAg + H2SO4 = т.к. серебро
- 33. Н2SO4 + Ме (до Н2)
- 34. Раствор серной кислоты взаимодействует с основными
- 35. Серная кислота взаимодействует с основаниями и амфотерными
- 36. Серная кислота взаимодействует с солями, если образуется
- 37. Взаимодействие концентрированной серной кислоты с металлами.Me +
- 38. Соли серной кислотыСерная кислота как двухосновная кислота
- 39. СВОЙСТВА СУЛЬФАТОВСульфаты при нагревании разлагаются (кроме сульфатов
- 40. Производство серной кислотыПроизводство H2SO4 в мире неуклонно
- 41. Слайд 41
- 42. Производство серной кислоты контактным способом
- 43. Серная кислота используется для получения фосфорных и
- 44. Применение серной кислоты в металлургии«Травление» –
- 45. Серная кислота используется в качестве электролита в автомобильных аккумуляторах.
- 46. H2SO4Лекарственные препаратыСинтетические моющие средства
- 47. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Н2S
СЕРОВОДОРОД
Встречается в природе в составе нефти, природного газа, вулканического
газа и в горячих источниках. . Кроме того, он образуется
при разложении белков погибших животных и растений, а также при гниении пищевых отбросов.Слайд 4СТРОЕНИЕ МОЛЕКУЛЫ
Молекула сероводорода имеет угловую форму, поэтому она полярна. В
отличие от молекул воды, молекулы сероводорода не образуют прочных водородных
связей, поэтому H2S — газ.Слайд 5ФИЗИЧЕСКИЕ СВОЙСТВА
ядовитый газ тяжелее воздуха с неприятным запахом тухлых яиц,
растворимый в воде. Насыщенный водный раствор H2S является сероводородной кислотой.
Слайд 6ПОЛУЧЕНИЕ
В лаборатории обычно получают действием разбавленных кислот на сульфиды:
FeS
+ 2HCl = FeCl2 + H2S
Или при добавлении к сульфиду
алюминия воды: Al2S3 + H2O = 2Al(OH)3 + H2S
водород + сера H2 + S = H2S
конц. серная кислота + активный металл
8Na + 5H2SO4 -----4Na2SO4 + H2S + 4H2O
Слайд 7ХИМИЧЕСКИЕ СВОЙСТВА
Сероводород — сильный восстановитель.
сгорание
2H2S + 3O2 =2SO2 + 2H2O
взаимодействие с
некоторыми солями тяжелых металловH2S + CuCl2 = CuS + 2HCl
взаимодействие с некоторыми неорганическими веществами по реакциям окисления-восстановления
2H2S + SO2 =3S + 2H2О
Слайд 8ХИМИЧЕСКИЕ СВОЙСТВА
В воде сероводород мало растворим, водный раствор H2S является
очень слабой кислотой:
H2S → HS− + H+
С основаниями реагирует:
H2S
+ 2NaOH = Na2S + 2H2O (обычная соль, при избытке NaOH)
H2S + NaOH = NaHS + H2O
(кислая соль, при отношении 1:1)
Слайд 10ПРИМЕНЕНИЕ
Сероводород из-за своей токсичности находит ограниченное применение.
В аналитической химии сероводород
и сероводородная вода используются как реагент для осаждения тяжёлых металлов,
сульфиды которых очень слабо растворимыВ медицине — в составе сероводородных ванн
Сероводород применяют для получения серной кислоты, элементной серы, сульфидов
Используют в органическом синтезе для получения тиофена и меркаптанов
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического и химического сырья.
Слайд 12СЕРНИСТЫЙ ГАЗ
SO2
Нахождение в природе
Оксид серы (lV) – сернистый газ, являющийся
одним из главных загрязнителей атмосферного воздуха, кислотный оксид, очень хорошо
растворимый в воде, образует слабую сернистую кислотуСлайд 14ПОЛУЧЕНИЕ
В промышленности: обжиг сульфидов:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑
ZnS + O2 = ZnO + SO2
Слайд 15ФИЗИЧЕСКИЕ СВОЙСТВА
бесцветный газ с характерным резким удушливым запахом (запах загорающейся
спички); хорошо растворяется в воде с образованием нестойкой сернистой кислоты;
под давлением сжижается при комнатной температуре; ядовит; обесцвечивает многие красители, убивает микроорганизмы.Слайд 16Химические свойства
оксида серы (IV)
Относится к кислотным оксидам. Растворяется в
воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
SO2
+ H2O ↔ H2SO3.Со щелочами образует сульфиты:
SO2 + 2NaOH → Na2SO3 + H2O.
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr,
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°С),
Слайд 17Химические свойства
оксида серы (IV)
Данная реакция является качественной реакцией на
сульфит-ион SO32- и на SO2 (обесцвечивание фиолетового раствора).
5SO2 + 2KMnO4
+ 2H2O → 2H2SO4 + 2MnSO4 + K2SO4.В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
SO2 + 2CO → 2CO2 + S↓.
Или для получения фосфорноватистой кислоты:
PH3 + SO2 → H(PH2O2) + S↓
Проявляет как свойства окислителя, так и восстановителя:
Слайд 18Оксид серы (IV) ПРИМЕНЕНИЕ
В пищевой
промышленности используется как консервант (Е220) . Используются при производстве многих
продуктов и полуфабрикатов, а также для дезинфекции тары. Негативно влияет на функции почек. Раздражитель дыхательных путей, может вызвать приступ астмы;Слайд 19Сернистая кислота
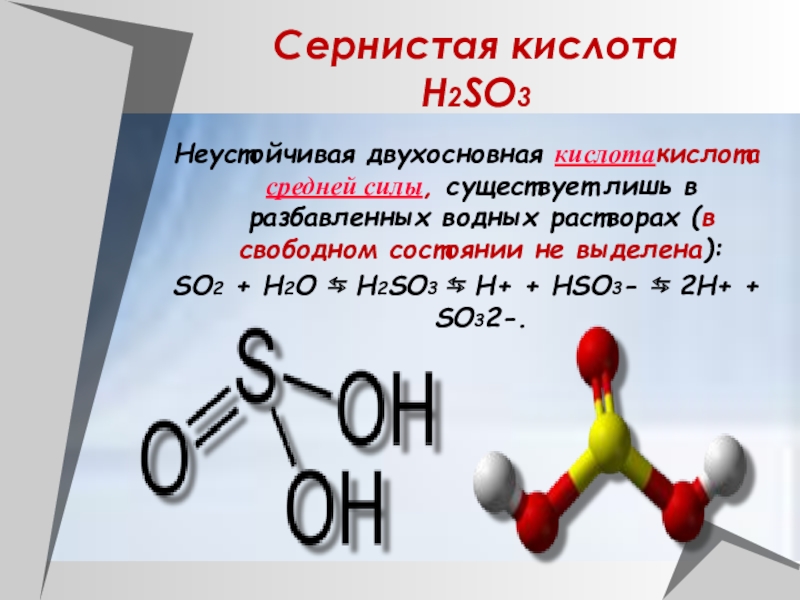
H2SO3
Неустойчивая двухосновная кислотакислота средней силы, существует лишь в
разбавленных водных растворах (в свободном состоянии не выделена):
SO2 + H2O
⇆ H2SO3 ⇆ H+ + HSO3- ⇆ 2H+ + SO32-.Слайд 20Соли ее – сульфиты, растворимые из них только соли щелочных
металлов.
Сульфиты - это средние соли (CaSO3),
но есть и кислые
– гидросульфиты (NaHSO3).Сульфиты и гидросульфиты реагируют
с сильными кислотами с образованием
сернистого газа
K2SO3 + 2HNO3---2KNO3 + SO2 + H2O
Слайд 21Применение
сернистой кислоты H2SO3
Сернистая кислота и её соли применяют как
восстановители, для беления шерстиСернистая кислота и её соли применяют как
восстановители, для беления шерсти, шелкаСернистая кислота и её соли применяют как восстановители, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей (хлора).Сернистую кислоту применяют при консервировании плодов и овощей.
Гидросульфит кальция Са(HSO3)2 (сульфитный щелок) используют для переработки древесины в так называемую сульфитную целлюлозуГидросульфит кальция Са(HSO3)2 (сульфитный щелок) используют для переработки древесины в так называемую сульфитную целлюлозу (раствор гидросульфита кальция растворяет лигнинГидросульфит кальция Са(HSO3)2 (сульфитный щелок) используют для переработки древесины в так называемую сульфитную целлюлозу (раствор гидросульфита кальция растворяет лигнин — вещество, связывающее волокна целлюлозы, в результате чего волокна отделяются друг от друга; обработанную таким образом древесину используют для получения бумаги).
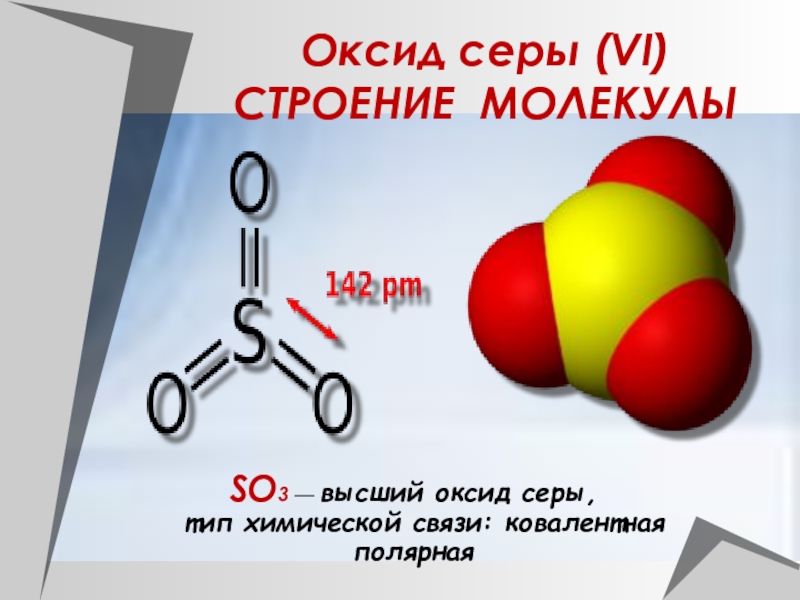
Слайд 23Оксид серы (VI) СТРОЕНИЕ МОЛЕКУЛЫ
SO3 — высший оксид серы,
тип химической связи: ковалентная полярная
Слайд 24Оксид серы (VI) Физические свойства
В обычных условиях легколетучая бесцветная жидкость
с удушающим запахом. При температурах ниже 16,9 °C застывает с
образованием смеси различных кристаллических модификаций твёрдого SO3.Слайд 25ХИМИЧЕСКИЕ СВОЙСТВА
Проявляет только свойства окислителя:
3SO3 + H2S → 4SO2 +
H2O
Растворяется в 100%-й серной кислоте, образуя олеум:
H2SO4 (100 %) +
SO3 → H2S2OПроявляют свойства типичного кислотного оксида:
Слайд 26ОКИСЛИТЕЛЬНО- ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА SO3
характеризуется сильными окислительными свойствами, восстанавливается, обычно,
до сернистого ангидрида:
5SO3 + 2P + 2P→ P2O5 + 5SO2
3SO3 + H2SS → 4SO2 + H2O
2SO3 + 2KI + 2KI → SO2 + I2 + K2SO4.
При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:
SO3 + HCl + HCl → HSO3Cl
Также присоединяет хлор, образуя тионилхлорид:
SO3 + Cl2 + 2SCl2 → 3SOCl2
Слайд 27в качестве растворителя в лабораториях;
в текстильной промышленности (отбеливание);
в качестве обесцвечивающего
вещества в сахарном
производстве, пищевой промышленности,
для дезинфекции помещений и
уничтожения паразитов на теле животныхСлайд 29Вулкан Малый Семячик
Вулканический хребет длиной около 3 км., на гребне
которого имеются три кратера. В южном (кратер Троицкого) на глубине
170м. находится необычное кислое озеро. Температура этого непрозрачного озера колеблется от +270С до +420С, а уровень минерализации соответствует раствору серной и соляной кислот средней концентрации. Поражают размеры озера: ширина около полукилометра, а глубина - до 140м. Существуют предположения, что кислотное озеро возникло сравнительно недавно в результате извержения вулкана, произошедшего незаметно для людей.НАХОЖДЕНИЕ В ПРИРОДЕ
Слайд 30Физические свойства серной кислоты.
Безводная серная кислота - это бесцветная маслянистая
жидкость без запаха,
смешивается с водой в любых отношениях,
t пл. =10,30 С, t кип = 2960С,
=1, 84 г/см3.
Обладает сильным водоотнимающим действием.
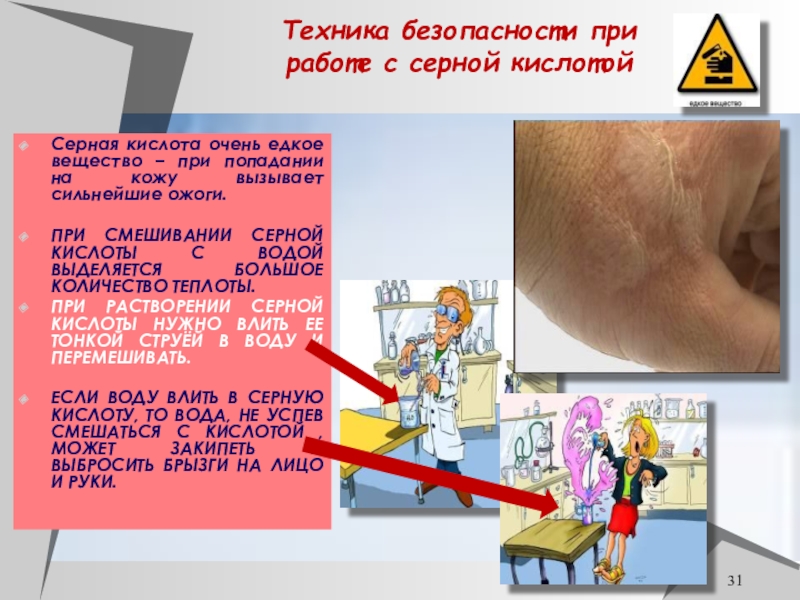
Слайд 31Техника безопасности при работе с серной кислотой
Серная кислота очень едкое
вещество – при попадании на кожу вызывает сильнейшие ожоги.
ПРИ СМЕШИВАНИИ
СЕРНОЙ КИСЛОТЫ С ВОДОЙ ВЫДЕЛЯЕТСЯ БОЛЬШОЕ КОЛИЧЕСТВО ТЕПЛОТЫ.ПРИ РАСТВОРЕНИИ СЕРНОЙ КИСЛОТЫ НУЖНО ВЛИТЬ ЕЕ ТОНКОЙ СТРУЁЙ В ВОДУ И ПЕРЕМЕШИВАТЬ.
ЕСЛИ ВОДУ ВЛИТЬ В СЕРНУЮ КИСЛОТУ, ТО ВОДА, НЕ УСПЕВ СМЕШАТЬСЯ С КИСЛОТОЙ , МОЖЕТ ЗАКИПЕТЬ И ВЫБРОСИТЬ БРЫЗГИ НА ЛИЦО И РУКИ.
Слайд 32ХИМИЧЕСКИЕ СВОЙСТВА
Ag + H2SO4 = т.к. серебро стоит в ряду
активности после водорода
2Al + 3H2SO4 = Al2(SO4)3 +3H2
2Al0
+ 6H+ = 2Al 3+ +3H20Раствор серной кислоты взаимодействует с металлами , стоящими в ряду активности до водорода.
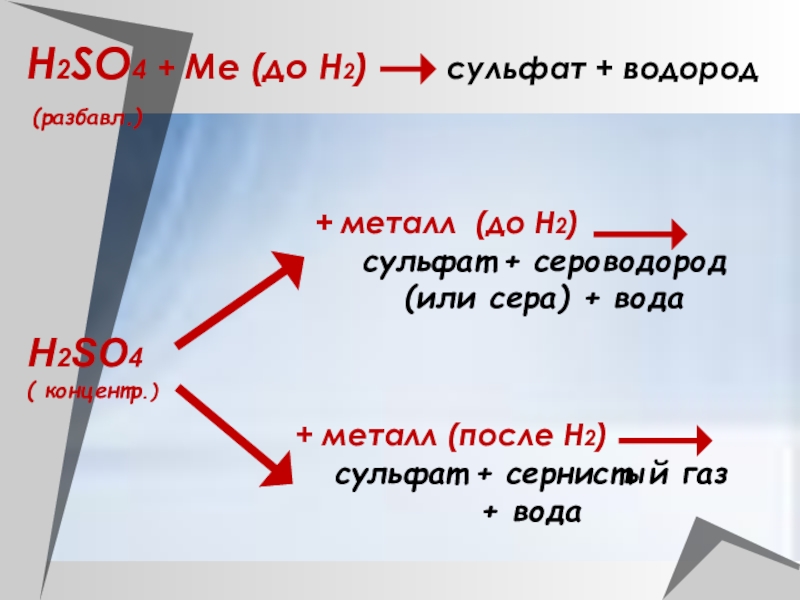
Слайд 33Н2SO4 + Ме (до Н2) сульфат
+ водород
Н2SO4
( концентр.)
+ металл (до Н2)
сульфат +
сероводород (или сера) + вода
+ металл (после Н2)
сульфат + сернистый газ
+ вода
(разбавл.)
Слайд 34 Раствор серной кислоты взаимодействует с основными и амфотерными оксидами.
МnO
+ H2SO4 = MnSO4 + H2O
МnO + 2H+
= Mn2+ + H2OMn2O7 + H2SO4 = т.к. Mn2O7 -кислотный оксид
Слайд 35Серная кислота взаимодействует с основаниями и амфотерными гидроксидами.
2КOН + H2SO4
= К2SO4 + 2H2O
сульфат калияОН- + H+ = H2O
КOН + H2SO4 = КНSO4 + Н2O
гидросульфат калия
OН- + 2H+ + SO42- = НSO4- + H2O
Слайд 36Серная кислота взаимодействует с солями, если образуется газ или осадок.
FeS
+ H2SO4 =FeSO4 +H2S
FeS + 2H+ =Fe2+
+H2SMg(NO3)2 + H2SO4 =
Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3
Ba2+ + SO42- = BaSO4
K2CO3 + H2SO4 = K2SO4 + CO2 + H2O
CO3 2- + 2H+ = CO2 + H2O
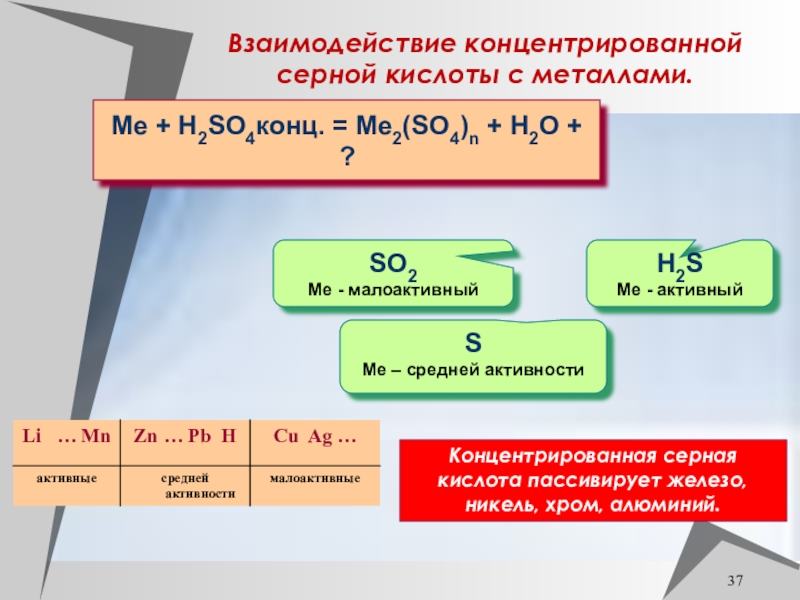
Слайд 37Взаимодействие концентрированной серной кислоты с металлами.
Me + H2SO4конц. = Me2(SO4)n
+ H2O + ?
S
Ме – средней активности
H2S
Ме - активный
SO2
Ме
- малоактивныйКонцентрированная серная кислота пассивирует железо, никель, хром, алюминий.
Слайд 38Соли серной кислоты
Серная кислота как двухосновная кислота образует два ряда
солей - кислые - гидросульфаты и средние - сульфаты. В
безводном состоянии выделены только гидросульфаты щелочных металлов. Средние сульфаты (безводные) - как правило, бесцветные кристаллические вещества, склонные к образованию кристаллогидратов (часто окрашеных), например:Na2SO4*10H2O - глауберова соль (мирабилит) - бесцветная
MgSO4*7H2O - горькая (английская) соль - бесцветная
CuSO4*5H2O - медный купорос - голубой
FeSO4*7H2O - железный купорос - голубовато-зеленый
CaSO4*2H2O - гипс - белый
Слайд 39СВОЙСТВА СУЛЬФАТОВ
Сульфаты при нагревании разлагаются (кроме сульфатов щелочных металлов, которые
термически устойчивы), например CaSO4 - при 1400oС:
2CaSO4 = 2CaO +
2SO2 + O2Сульфаты переходных металлов разлагаются при более низких температурах, например Fe2(SO4)3 - при 700-800oС:
Fe2(SO4)3 = Fe2O3 + 3SO3
Слайд 40Производство серной кислоты
Производство H2SO4 в мире неуклонно растет. Так, в
период с 2000 по 2005 год оно возросло со 160
до 189 млн тонн.В России объем производства серной кислоты c 2000 по 2005 год возрос в среднем на 1 млн тонн и составил 9,3 млн тонн.
Слайд 41
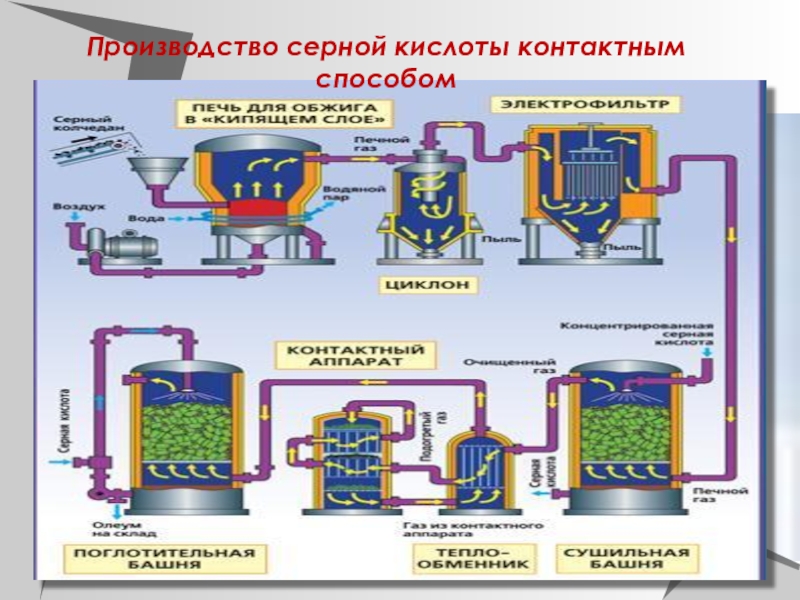
Производство серной кислоты
Сырьём для получения
серной кислотыСырьём для получения серной кислоты служат сераСырьём для получения
серной кислоты служат сера, сульфидыСырьём для получения серной кислоты служат сера, сульфиды металловСырьём для получения серной кислоты служат сера, сульфиды металлов, сероводородСырьём для получения серной кислоты служат сера, сульфиды металлов, сероводород, отходящие газы теплоэлектростанций, сульфатыСырьём для получения серной кислоты служат сера, сульфиды металлов, сероводород, отходящие газы теплоэлектростанций, сульфаты железаСырьём для получения серной кислоты служат сера, сульфиды металлов, сероводород, отходящие газы теплоэлектростанций, сульфаты железа, кальция и др.Основные этапы получения серной кислоты:
Обжиг сырья с получением SO2
Окисление SO2 в SO3
АбсорбцияАбсорбция SO3
В промышленности применяют два метода окисления SO2 в производстве серной кислоты: контактный — с использованием твердых катализаторов в производстве серной кислоты: контактный — с использованием твердых катализаторов (контактов), и нитрозный — с оксидами азота.
Слайд 43Серная кислота используется для получения фосфорных и азотных удобрений: простого
суперфосфата, двойного суперфосфата, преципитата и сернокислого аммония.
при производстве 1
т. суперфосфата из фторапатита, не содержащего гигроскопической воды, расходуется 600 кг. 65-процентной серной кислоты Слайд 44Применение
серной кислоты в металлургии
«Травление» – обнаружение трещин на поверхности
металлов.
В гальванических цехах серную кислоту используют для обезжиривания поверхности металла
перед нанесением покрытия.Переработка руд редких металлов