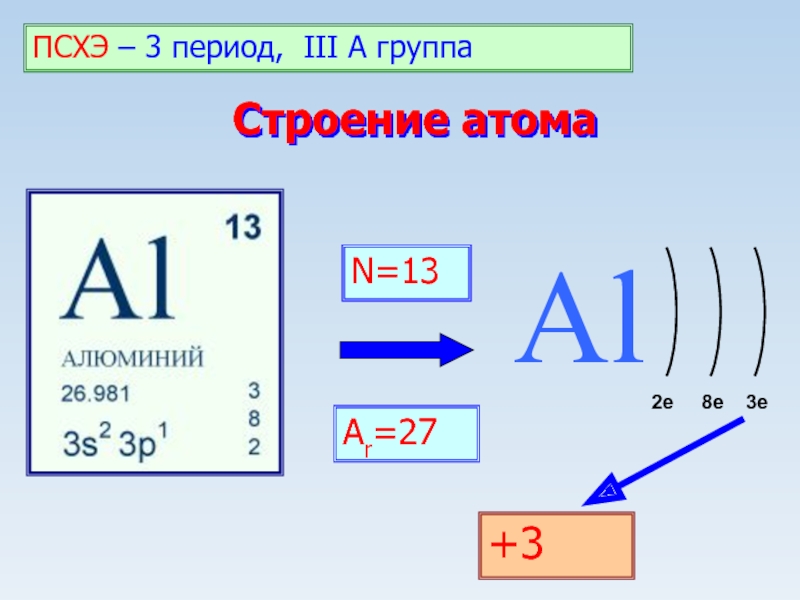
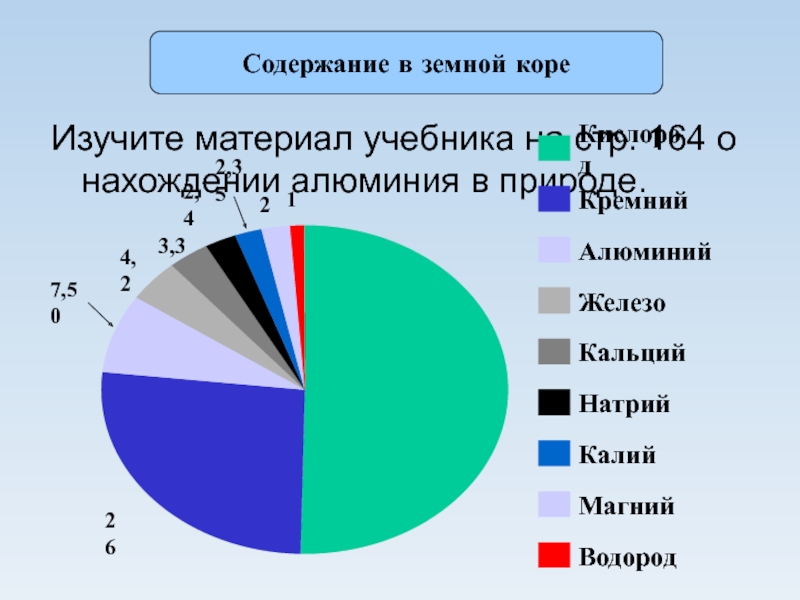
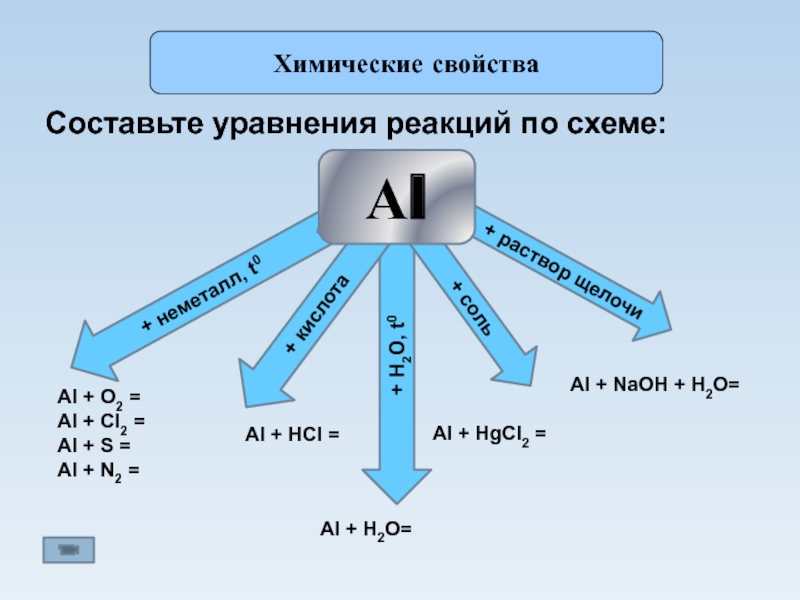
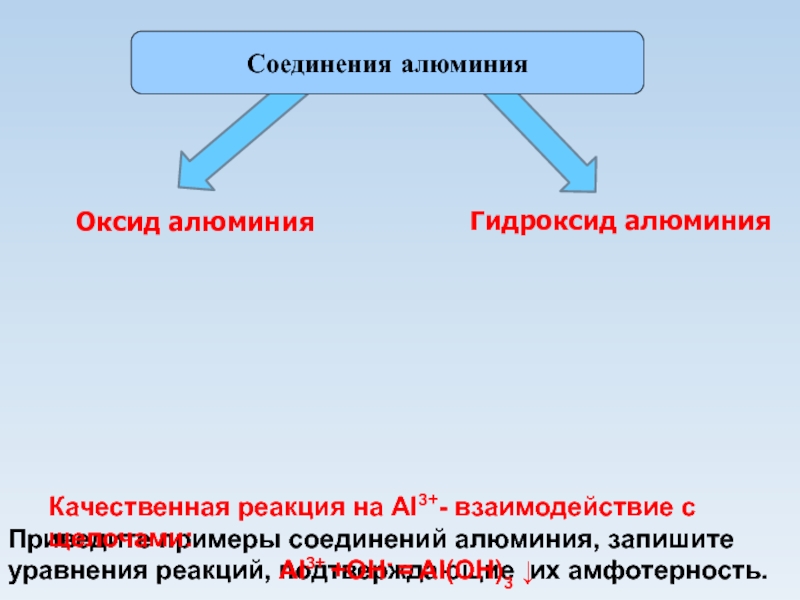
из глины».
В период его открытия он был дороже золота.
Англичане
хотели почтить богатым подарком великого русского химика Д.И Менделеева, подарили ему химические весы, в которых одна чашка была изготовлена из золота, другая - из этого металла. Есть легенда, что император Франции Наполеон III, желая продемонстрировать свое превосходство, заказал себе камзол с пуговицами из этого металла, который надевал исключительно во время дипломатических приемов.